长春高新要撕掉仅有生长激素的标签,加码创新药。
10月9日,界面新闻记者从长春高新获悉,为深化长春高新全球化战略布局,加快长春高新国际化进程,增强公司在境外融资能力,进一步提升公司国际品牌形象,长春高新拟发行境外上市外资股(H股)股票并申请在香港联合交易所有限公司主板挂牌上市。
长春高新向界面新闻记者表示,本次发行上市募集资金在扣除相关发行费用后拟用于研发创新、在研产品的临床试验、注册备案及商业化;推进公司业务出海,建设海外产品销售网络;加强销售及营销活动以巩固及扩大市场领导地位;意向并购及引进;补充运营资金等用途。
从此次募资用途来看,主要涉及两个方向:一是推动创新管线,包括临床试验推进、临床前项目开发及相关监管事务;二是在海外组建商业化团队,用于潜在的全球合作、共同开发及市场拓展。
募资用途能否形成第二增长曲线是长春高新上市后溢价的关键。
自2022年以来,长春高新频频因生长激素集采传闻导致股价大幅波动。2024年,长春高新还交出了近二十年来首次营收与净利润双双下滑的年报,标志着其赖以成名的“生长激素神话”在集采政策下彻底破灭。
那么,长春高新的创新药管线究竟成色几何,能否支撑其走出生长激素依赖。
界面新闻记者了解到,目前长春高新已布局超过40个处于临床阶段或已递交新药临床试验申请(IND)申请的管线项目,其中包括11个I类创新生物制剂和4个I类创新化学药物,主要覆盖内分泌与代谢、女性健康、免疫与呼吸系统及肿瘤等领域。在治疗性药物管线中,已有5个项目同时获得国家药监局及美国食品药品监督管理局的新药临床试验申请批件。

界面新闻记者从招股书获取
在内分泌代谢疾病领域,长春高新的核心创新药管线是GenSci134。该产品有望成为全球首个长效生长激素(LAGH)月制剂。
该药正在中国开展成人生长激素缺乏症(AGHD)I期临床试验,并已就儿童生长激素缺乏症(PGHD)和特发性身材矮小症(ISS)向国家药监局递交IND申请并获批。2025年8月,长春高新已向国家药监局提交PGHD和ISS的新药临床试验申请,计划于2026年上半年在国内启动I期临床试验,并计划在同年上半年向美国食品药品监督管理局提交新药临床试验申请申请。
截至目前,已有两款长效生长激素药物获得国家药监局批准,另有三款候选药物已递交新药生产上市注册申请(NDA),且均为每周注射一次的剂型。不过,这些LAGH药物都是周制剂。
在此背景下,GenSci134作为一款革命性的月制剂,具备突破现有治疗格局的潜力。但其最大风险仍在于临床试验不确定性。由于GenSci134仍处于I期临床阶段,后续试验中任何不利结果都有可能对项目前景及公司估值造成影响。
界面新闻根据招股书基于整个生长激素市场规模出发,假设市占率,得到收入和利润,对GenSci134进行简单估值。该方法把所有患者群体(PGHD、ISS、AGHD)合并在一起,忽略了不同适应症的诊断率、竞争格局、支付路径差异。
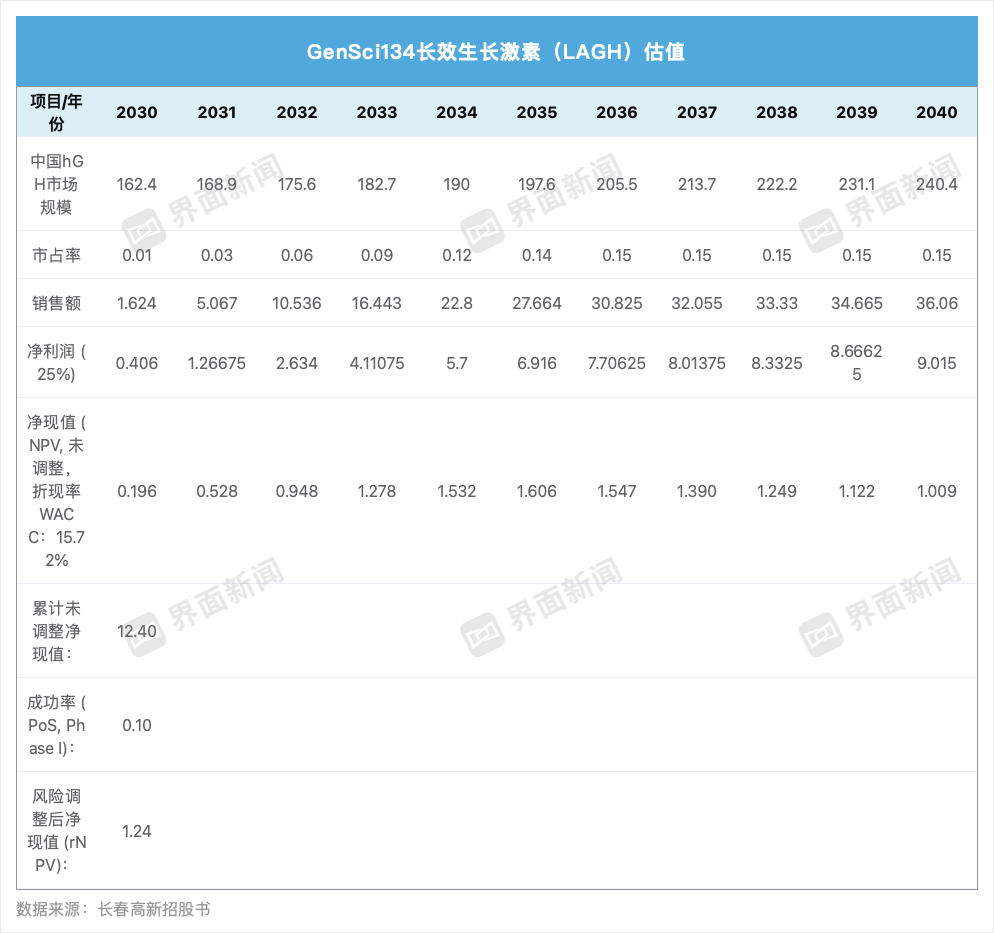
界面新闻记者制图
在女性健康领域,长春高新的核心创新药管线是GenSci074。该产品是一款神经激肽3受体(NK3R)拮抗剂,目前处于Ⅱ期临床阶段,主要用于治疗女性更年期的血管舒缩症状(VMS)。
截至目前,美国食品药品监督管理局仅批准了一款NK3R拮抗剂产品,而中国尚无同类药物获得国家药监局批准。
在国内市场中,安斯泰来制药的Fezolinetant进展最快,已进入Ⅲ期临床;长春高新的GenSci074处于Ⅱ期;恒邦药业与翰森制药联合开发的HS-10384同样处于Ⅱ期;拜耳的Elinzanetant则处于Ⅰ期临床,但其作用机制为NK1R/NK3R双靶点。
界面新闻同样根据招股书粗略测算,以中国血管舒缩症患者群体规模为基础,考虑Ⅲ期临床推进与NDA审批时间,假设GenSci074最早上市时间约为2029年,这为其留出了约4至5年的研发与注册周期。
从竞争格局看,Fezolinetant作为全球首个获批的NK3R拮抗剂,并已在中国进入Ⅲ期临床,极有可能较GenSci074提前1至2年上市,长春高新的GenSci074将作为市场跟随者进入。
这一领域在中国仍属蓝海市场,目前无同类药物获批上市,且大量患者对传统激素替代疗法(HRT)持谨慎态度,为非激素疗法提供了巨大的市场空间,但其能否兑现市场预期仍取决于后续临床验证及商业化执行力。
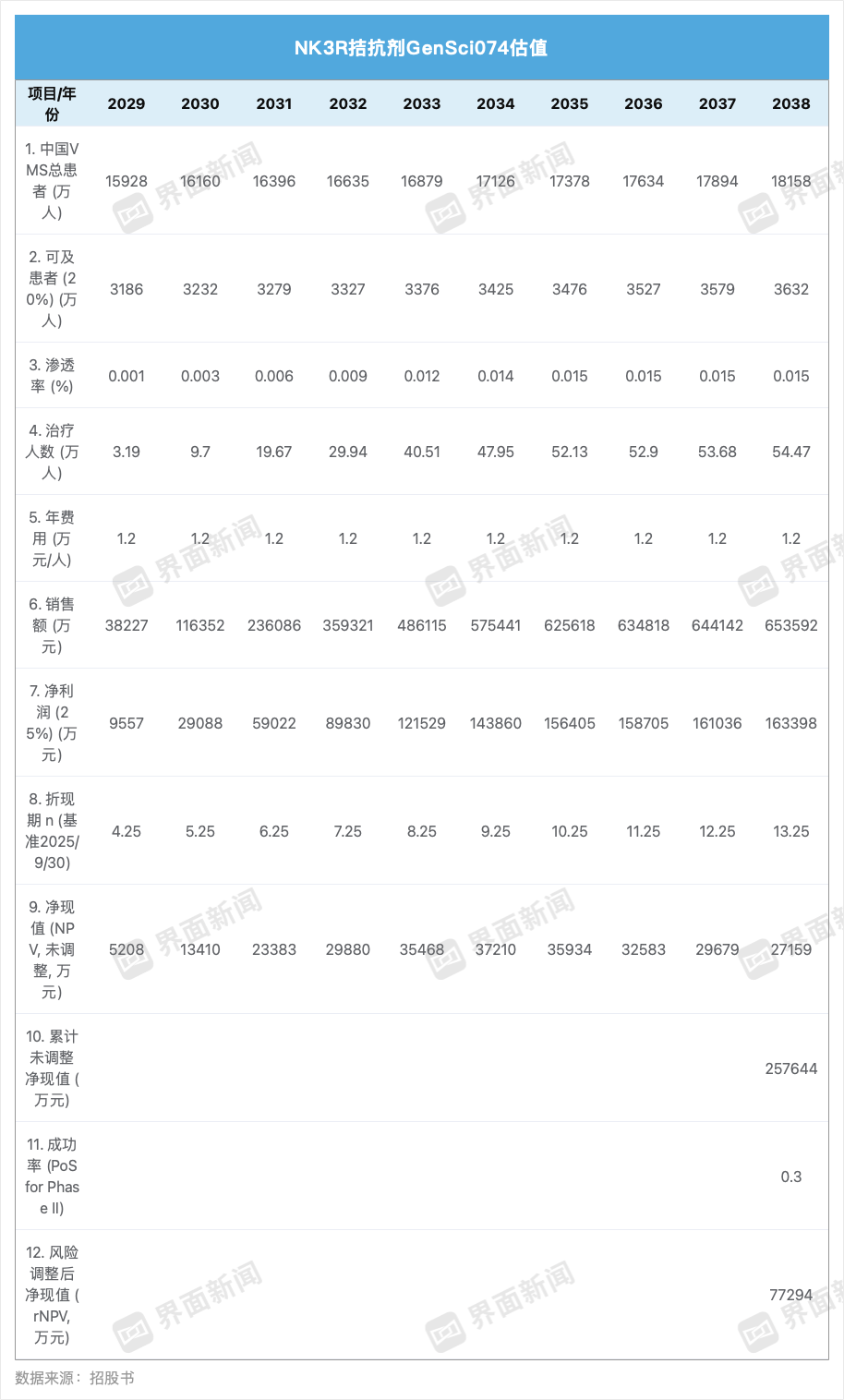
界面新闻记者制图
在肿瘤领域,长春高新也已布局多个针对前列腺癌、乳腺癌及卵巢癌的创新药管线。
其中最具代表性的三款产品分别为:具有全球同类首创潜力的EGFR×HER2双靶点BsADC药物 GenSci139;靶向FRα双表位的ADC药物GenSci140;以及靶向B7-H3与PSMA双靶点的BsADC药物GenSci143。
GenSci139、GenSci140和GenSci143都预计将于2025年第四季度获得国家药监局的新药临床试验申请批件并启动Ⅰ期临床试验。但目前尚不清楚这些药将首先切入哪个肿瘤类型(如乳腺癌、非小细胞肺癌或胃癌)及治疗线(如末线或二线)。不同的选择将直接影响其目标市场规模、竞争格局及未来定价策略,短期内难以对其进行合理估值。
GenSci139是典型的高风险、高回报型的创新药资产。其瞄准了已被多项国际临床研究验证、潜在市场规模高达数百亿美元的HER2低表达肿瘤治疗领域,通过双靶点机制(EGFR×HER2),试图在DS-8201(Enhertu,第一三共/阿斯利康)等现有ADC疗效有限的适应症中取得突破。
但GenSci139也面临高度拥挤的竞争环境和执行的不确定性。待其真正进入市场时,ADC领域可能已被十余款新老药物充分开发与教育,竞争者不仅包括DS-8201的后续代产品,还包括其他靶点的ADC、双抗甚至细胞治疗。到那时候,其不仅需证明其疗效,更要证明其相较标准疗法具有显著优势,临床与商业化门槛都极高。
从当前全球竞争格局来看,目前仅有一款EGFR ADC(由乐天制药开发的沙妥昔单抗)在日本获批,全球其他地区尚无EGFR ADC获批。在全球范围内,有两款EGFR单靶点ADC处于Ⅲ期临床阶段,另有三款处于早期临床阶段;在中国,则有两款处于Ⅲ期,三款处于早期临床阶段。
HER2靶点方面,截至目前,已有两款HER2单靶点ADC获FDA批准的第一三共/阿斯利康的德曲妥珠单抗(DS-8201)与罗氏的恩美曲妥珠单抗(T-DM1)。在中国,已批准的HER2 ADC包括DS-8201、恩美曲妥珠单抗、荣昌生物的维迪西妥单抗及恒瑞医药的瑞康曲妥珠单抗。此外,全球仍有两款HER2 ADC处于Ⅲ期临床、六款处于早期阶段;在中国,则有11款处于Ⅲ期、7款处于早期研究阶段。
FRα靶点的GenSci140则可以视为在一座已被证明可行的山峰上尝试更进一步。相比GenSci139未来可能面临的惨烈竞争格局,GenSci140的研发路径和竞争坐标系更为清晰,其潜在的领先优势也更为可预期。
截至目前,全球范围内仅有一款FRα单靶点ADC药物索米妥昔单抗(Elahere)获批上市。Elahere主要用于治疗FRα高表达的卵巢癌患者,但其适应人群仅覆盖约35%至40%的患者,对中低表达人群基本无效。
截至目前,无论在全球还是中国,尚无FRα双表位ADC获批。全球仅有艾伯维的IMGN151处于II期临床阶段,而长春高新的GenSci140已向国家药监局递交IND申请,并成为中国唯一在研的FRα双表位ADC管线。
能否成为同类最佳,将成为GenSci140的核心竞争策略。通过双表位结合设计与自主ADC技术平台,GenSci140不仅有望显著扩大患者覆盖范围(从高表达拓展至中低表达群体),还可能在疗效上实现突破。
根据招股书披露的临床前研究结果,GenSci140在多种CDX动物模型(包括卵巢癌、非小细胞肺癌、三阴性乳腺癌)中均展现出优于Elahere的体内抗肿瘤活性,且该活性与肿瘤组织中FRα的表达水平无显著相关性。这意味着,GenSci140有望将潜在受益患者群体从目前的约35%-40%扩大至70%-80%甚至更高。
但Elahere仍是目前市场的标尺。GenSci140不仅要证明有效,还必须证明其在疗效或安全性上显著优于Elahere,或者能覆盖Elahere无效的患者群体。若未来临床结果仅能证明非劣效,则其作为后入者将在市场推广、医保谈判与定价策略上面临更大压力。
GenSci143则是一款同时靶向 B7-H3 与 PSMA 的双靶点BsADC。据弗若斯特沙利文数据,大约97%的前列腺癌患者中至少有一个抗原(B7-H3或PSMA)呈高水平表达。
基于此,通过同时靶向这两种抗原,GenSci143在理论上具备更广泛的患者覆盖率与更高的商业化潜力,其广谱性与普适性设计有望突破单靶点药物的适用局限。
但目前,GenSci143仍处于极早期研发阶段,项目风险较高。此外,其研发周期较长、竞争格局亦将日趋激烈。按照当前开发进度推算,GenSci143进入市场时,预计将面临多款已获批的单靶点B7-H3 ADC及PSMA ADC药物竞争。到时候,GenSci143需通过明确且优于同类产品的临床数据,证明其疗效优势足以支撑差异化定位,否则在商业化推进中将面临较大挑战。
截至目前,全球及中国市场均尚无B7-H3 ADC获批。全球范围内共有两款处于III期、四款处于II期临床阶段;在中国,有四款处于III期、九款处于早期临床阶段。
与此同时,全球或中国范围内也尚无PSMA ADC药物获批。全球共有一款处于II期、三款处于I期临床阶段,中国则有一款处于I期临床阶段。
在免疫与呼吸系统疾病领域,长春高新同样布局了创新药管线GenSci098。该产品是一款用于治疗甲状腺相关眼病(TED)的TSHR拮抗剂。

