被称为医药研发“死亡谷”的阿尔茨海默病(AD),有何魔力?
11月24日晚间,丹麦制药巨头诺和诺德宣布,针对司美格鲁肽治疗阿尔茨海默病的两项大型Ⅲ期试验均未达到主要目标;而在不久前,中国药企绿叶制药宣布,公司自研的LY03017已获得美国食品药品监督管理局(FDA)许可开展临床试验,其中的一项适应证与阿尔茨海默病有关。
这并不是个例。上周,康方生物自研的AK152获批临床,用于治疗阿尔茨海默病,成为国内首个进入临床阶段的AD双抗药物;恒瑞医药的SHR-1707,作为国内首个自研抗Aβ单抗,已经进入Ⅱ期临床阶段;先通医药、原子高科等致力于AD早期诊断的药企研发也在路上。
一方面,跨国药企在AD药物研发和商业化的道路上屡次受挫;另一方面,中国药企对这一领域的研发热情日益高涨。后者有希望成为全球AD治疗领域的新破局者吗?
中国阿尔茨海默病药物研发数量位居全球第二
11月24日,诺和诺德公布了口服GLP-1药物司美格鲁肽(Semaglutide)针对早期阿尔茨海默病患者进行的Evoke和Evoke+三期试验的顶线结果,两项实验均未证实司美格鲁肽在减缓阿尔茨海默病进展方面优于安慰剂。
受此消息影响,公司美股盘前直线下挫,而最近刚挤进“万亿美元市值俱乐部”的礼来,因为同样拥有GLP-1(胰高血糖素样肽-1)类药物,且在阿尔茨海默病领域有所布局,盘前股价一度跌超5%。
此前,辉瑞、罗氏、强生、渤健等跨国药企,均有在阿尔茨海默病领域折戟的经历,其根本原因在于阿尔茨海默病的病因和发病机制仍未明确,即便主流的Aβ与tau蛋白异常假说也屡遭质疑。
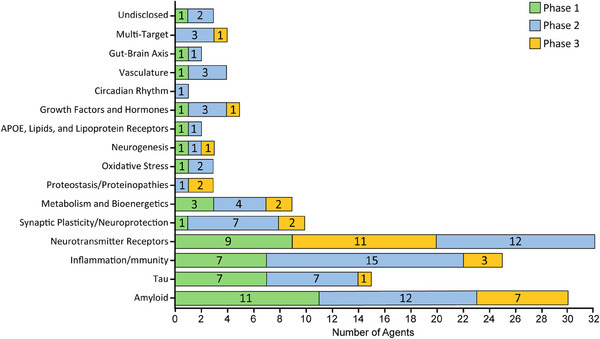
不同作用机制分类的AD药物在各研究阶段的数量
图片来源:《阿尔茨海默病在研药物管线全景2025》截图
在跨国药企中,渤健和礼来一直是神经疾病药物研发领域的领头羊,但双方都在2025年砍掉了阿尔茨海默病的研发管线,前者砍掉的BIIB113项目是一款旨在通过阻止tau蛋白聚集,治疗早期阿尔茨海默病的口服小分子药物,礼来砍掉的LY3372689,同样是一款口服抗tau药物,去年8月,公司宣布该药物在治疗早期症状性AD的Ⅱ期研究中失败。
与此形成对比的是,中国药企在AD领域热情高涨。去年,智慧芽全球新药数据库显示,中国针对AD适应证药物研发的数量仅次于美国,排在第二位。
据《每日经济新闻》记者统计,截至目前,中国原创AD在研药物包括恒瑞医药的SHR-1707(抗Aβ单克隆抗体)、康方生物的AK152(靶向Aβ和BBB高表达受体的双特异性抗体)、绿叶制药的LY03017(5-HT2AR反向激动剂/5-HT2CR拮抗剂)、深圳理工大学的BrAD-R13片(口服TrkB受体激动剂)、卓凯生物的50561片(Rac1抑制剂)等。
近年获批新药销售不及预期,中国药企布局为何增多?
尽管中国药企对AD药物的研发热情有所升温,但跨国药企得益于多年积累,仍掌握着全球AD药物市场。
根据2022年5月发表于《中国合理用药探索》的文章《阿尔茨海默病的发病机制和药物研发进展》,全球获批上市的AD原创药物几乎来自外国药企,仅甘露特纳一款由中国药企研发、获国家药品监督管理局(NMPA)“全球首批”。今年6月,甘露特纳传出停产的消息。
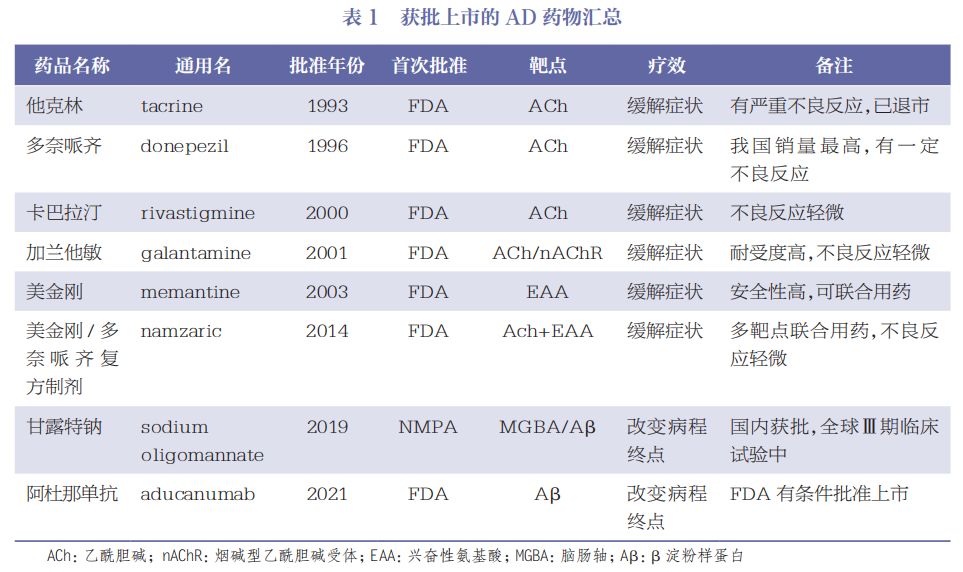
截至2022年,获批上市的AD药物汇总
图片来源:《阿尔茨海默病的发病机制和药物研发进展》截图
记者注:由于两个3期临床试验结果互相矛盾,临床获益并不明确,阿杜那单抗于2024年1月31日退出了AD治疗的舞台。另外,卫材/渤健联合研发的仑卡奈单抗(Lecanemab)、礼来的多奈单抗(Donanemab)分别于2023年和2024年在美获批,这是全球“唯二”获批的治疗Aβ抗体药物。
实际上,跨国药企的几款AD新药战绩不佳。去年3月,卫材公司预期仑卡奈单抗在2027财年的销售额约为5000亿日元(约33.3亿美元),但最新预期为2500亿日元到2800亿日元(约合16.65亿美元至18.65亿美元);而礼来的多奈单抗遭到英国医保监管机构拒绝,原因是监管机构认为该药物的益处太小,不足以证明其价格合理。
在此背景下,国内药企的研发信心源于何处?11月24日,绿叶制药方面接受了《每日经济新闻》记者采访,在公司看来,有临床需求和技术进步两方面原因在推动。
一方面,当前AD诊疗技术已显著成熟,生物标志物检测(如脑脊液Aβ、tau蛋白)、多模态医学影像(如PET-CT、MRI)与标准化临床症状量表(如MMSE、NPI)的结合,大幅提升了AD的诊断精准度,已从技术层面缓解了行业性诊断难题。
另一方面,AD领域内有庞大且未被满足的刚性需求。以公司布局的ADP(阿尔茨海默病精神病性障碍)为例,25%至50%的阿尔茨海默病患者会在疾病病程中出现该精神症状,但目前该领域没有获批药物。公司日前发布的公告显示,FDA豁免了LY03017在1期临床试验中单次给药剂量递增(SAD)试验环节,该药物后续可直接启动多次给药剂量递增(MAD)以及后续的临床试验。
不过,记者注意到,绿叶制药在国内、美国开展的临床试验,后续可能不只针对ADP这一个适应证,而是同步推进ADP、帕金森病精神病性障碍(PDP)、精神分裂症阴性症状(NSS)三个适应证的研究。在排序上,公司方面表示,将基于临床进展动态优化推进节奏。

