近日,第76届美国肝病研究协会(AASLD)年会于华盛顿落下帷幕,全球乙肝新药研发成果集中爆发。我国的贺普药业、$广生堂(SZ300436)$广生堂、柯君医药等企业凭借突破性成果备受关注,其中贺普拉肽联合干扰素实现乙肝“灭菌性治愈”、AHB-137停药后持久清除率达39%等数据,让曾经遥不可及的“临床治愈”目标,如今正逐渐成为现实。
一、2025年乙肝新药研发热点:AASLD大会重磅数据解析
乙肝新药研发一直是医学领域的“硬骨头”。与往年相比,今年乙肝新药研究重点明显从单纯的病毒抑制转向功能性治愈,多款创新药物展现出突破性疗效,尤其在HBsAg清除率方面,多个药物达到新高度,为乙肝患者带来了真正的治愈希望。与此同时,新药联合治疗的探索明显加速。数据显示,许多新药单药在I期或II期研究中未达到主要疗效目标,促使企业积极开展不同联合治疗方案的探索。
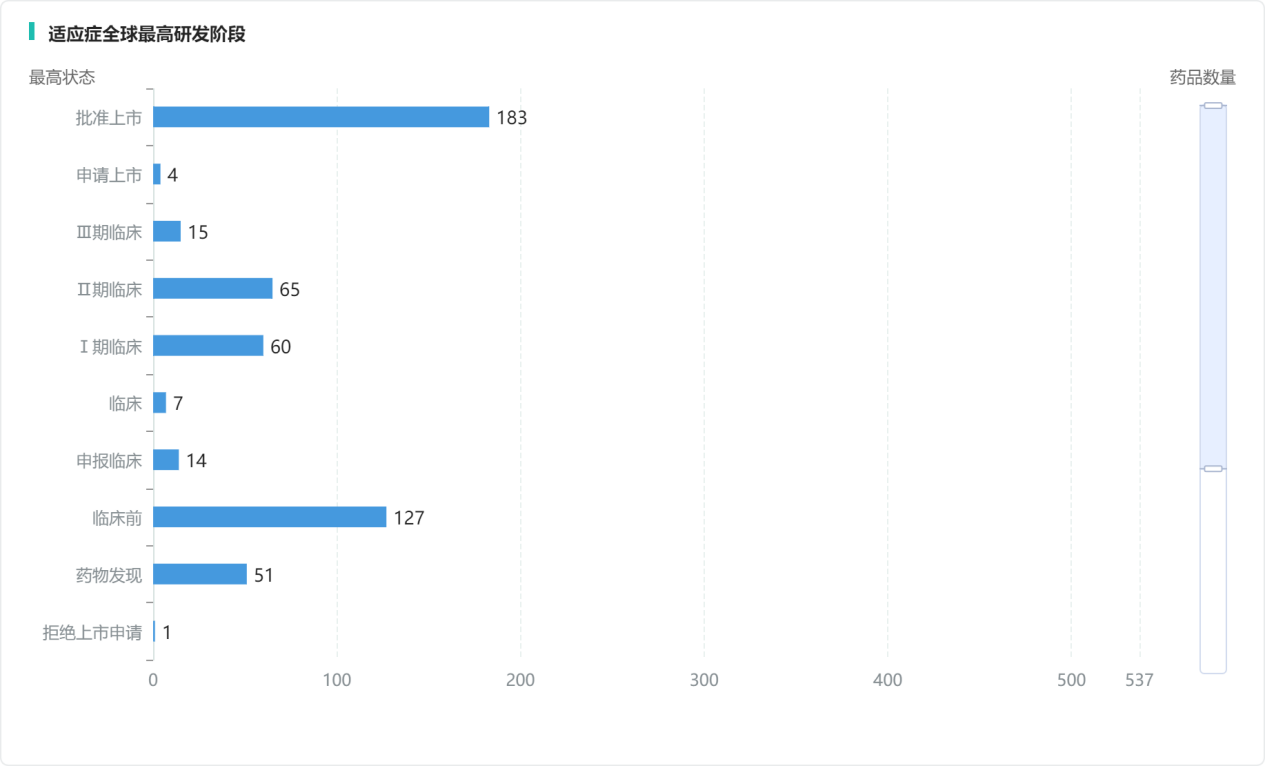
目前,慢性乙型肝炎(CHB)新药研发方向,主要包括进入抑制剂、小干扰RNA(siRNA)、反义寡核苷酸(ASO)、HBsAg抑制剂、衣壳抑制剂、治疗性疫苗、Toll样受体(TLR)激动剂和免疫检查点抑制剂等。据摩熵医药数据库统计,目前全球已有超过150款乙肝新药进入临床阶段,其中19款处于临床III期及以上,65款处于II期,60款处于I期。
乙型肝炎全球在研新药研发阶段分布
1.GSK836(Bepirovirsen)
Bepirovirsen是靶向所有HBVRNA的一种非结合型反义寡核苷酸,目前正处于治疗慢性HBV感染的III期研发阶段,预计2026年提交全球上市申请。
B-Together(NCT04676724)的研究数据显示,部分接受NAs治疗的参与者,在接受了12或24周bepirovirsen和24周聚乙二醇干扰素-2a(Peg-IFN)序贯治疗后,达到了完全应答(CR)或部分应答(PR)。该应答在Peg-IFN治疗结束后持续了24周。这些达到CR或PR的参与者被纳入B-Sure的长期疗效随访研究。
本次报告B-Together研究中CR和PR参与者进入B-Sure研究后,长达2年的应答持久性随访数据。研究数据显示,接受Bepirovirsen联合Peg-IFN序贯治疗的CR参与者,其功能性治愈可持续长达1年。
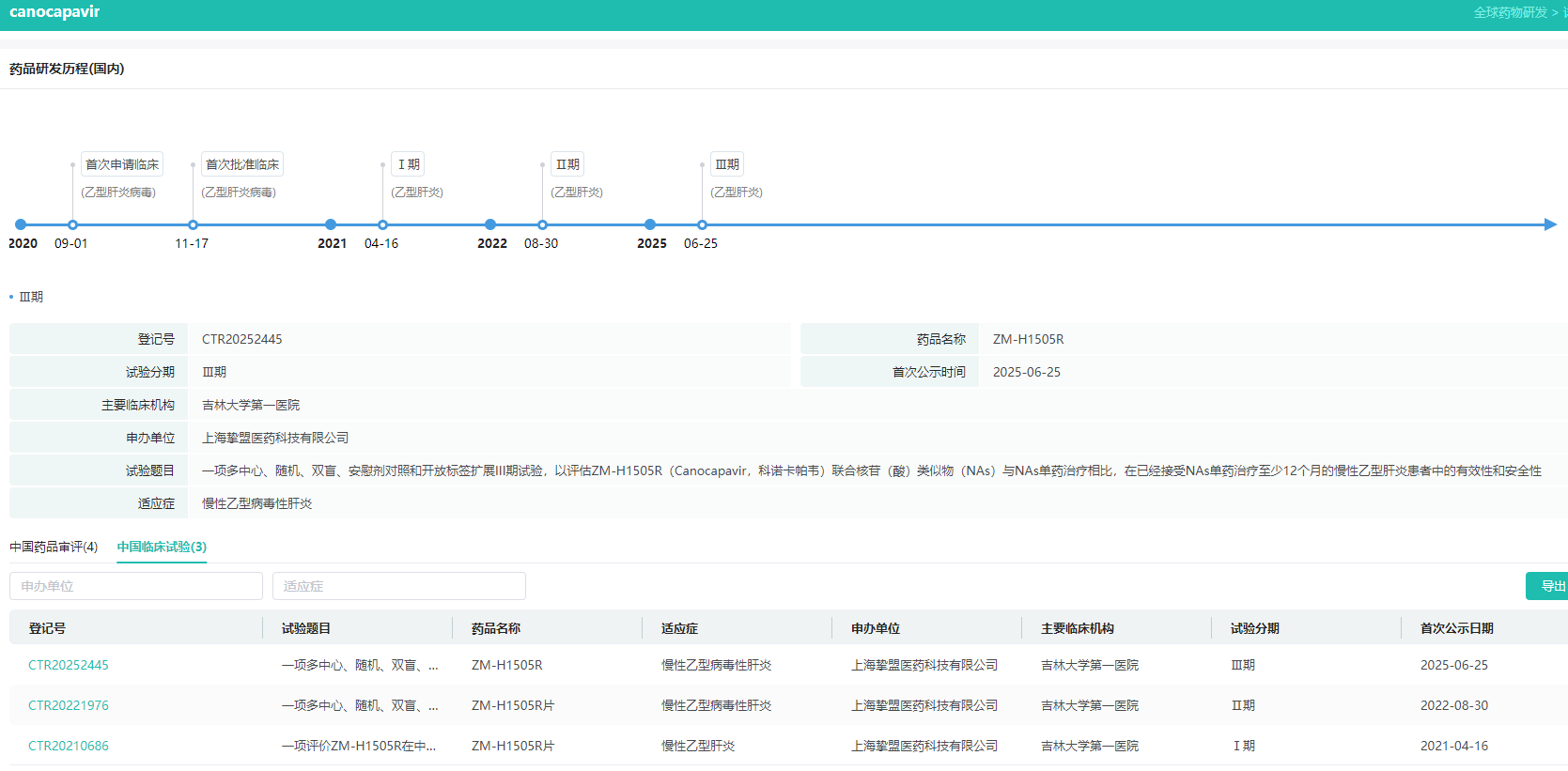
2.ZM-H1505R(Canocapavir)
ZM-H1505R(Canocapavir,科诺卡帕韦)是上海挚盟医药自主研发的新一代病毒核衣壳抑制剂,可以有效抑制HBV核衣壳形成的小分子候选化合物。不同于其它在研的I型和II型HBV衣壳组装调节剂,Canocapavir为全新的吡唑类核衣壳抑制剂,相对于现有乙肝治疗药物该款药物具有全新的作用机制。目前ZM-H1505R正在进行III期临床试验。
ZM-H1505R国内研发历程
本次AASLD2025大会摘要中公布了ZM-H1505R的II期临床数据。CanocapavirⅡ期研究(NCT05484466)旨在评估该药物在恩替卡韦(ETV)治疗的慢性乙型肝炎(CHB)低病毒血症(LLV)患者中的安全性、耐受性及疗效。
结果表明,对于HBVDNA降至低于10IU/mL并维持的低病毒血症(LLV)患者,Canocapavir与ETV的联合治疗总体上耐受性良好且有效。Canocapavir与ETV联合使用时增强了病毒抑制作用。这些发现支持进一步开发Canocapavir用于慢性乙型肝炎(CHB)的治疗。
3.GST-HG131
广生堂药业开发的口服小分子乙肝表面抗原抑制剂GST-HG131II期研究数据登上最新突破摘要(Late-breakingAbstract),并在现场报告。GST-HG131作为全球首个完成II期临床研究的口服HBsAg抑制剂,其便捷的口服给药方式显著提高了患者的用药可及性和依从性。
在临床II期研究中,GST-HG131在病人服用12周后从基线降低血清表面抗原值平均为0.9logIU/ml,最高达1.64logIU/ml;更重要的是,GST-HG131仅使用三个月就可将76.5%的乙肝病人血清表面抗原水平降低到100IU/ml以下。维持低水平的表面抗原水平(尤其是在100IU/ml以下)对改善乙肝病人的长期预后,包括肝硬化和肝细胞癌发生率具有重要意义和价值;表面抗原水平低于100IU/ml以下的病人对免疫重启也更敏感和更易达到临床治愈目标,为联合临床治愈提供关键支持。
GST-HG131的II期数据此前已因显示明显临床优势,于2025年7月被国家药监局审评中心纳入突破性治疗品种名单。此外,广生堂的另一款核衣壳抑制剂GST-HG141已进入III期临床,双药联合方案直击乙肝治愈核心,形成差异化竞争优势。
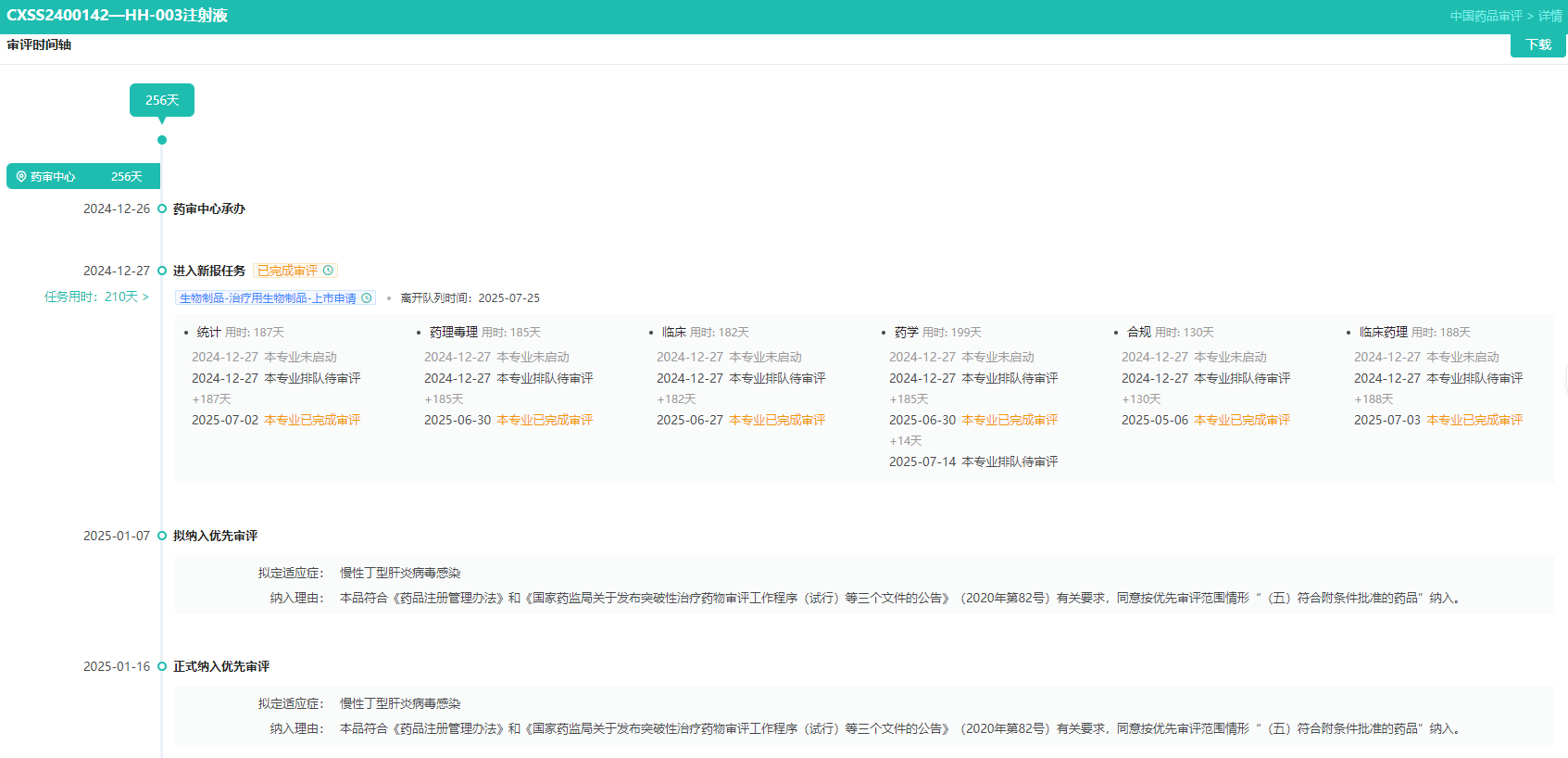
4.HH-003(Libevitug)
华辉安健在AASLD2025年会上以最新突破摘要口头报告形式,公布了自主研发的立贝韦塔单抗(HH-003)在治疗慢性丁型肝炎病毒(HDV)感染的关键注册临床2b期研究(HH003-204)48周的临床数据。
Libevitug(立贝韦塔单抗,HH-003)是一款靶向HBV大包膜蛋白前S1结构域的人源单克隆抗体,已分别被中国NMPA纳入突破性治疗品种,以及被美国FDA授予突破性疗法(BTD)认定证,用于治疗慢性HDV感染。目前HH-003的丁型肝炎、乙型肝炎适应症在国内均处于申请上市阶段。
HH-003审评时间轴
HH003-204研究结果表明,立贝韦塔单抗治疗慢性HDV感染者在复合终点应答率、病毒学抑制、ALT复常及肝脏硬度改善方面均显示出优于对照组的统计学显著且具有临床意义的疗效;立贝韦塔单抗两个治疗组在48周治疗期内均表现出良好的耐受性和优异的安全性。
5.AHB-137
AHB-137是浩博医药研发的一款反义寡核苷酸药物(ASO),目前已进入临床III期阶段。其在HBeAg阴性的慢性乙型肝炎(CHB)患者中,联合核苷(酸)类似物(NA)治疗的2a期(NCT06115993)和2b期(NCT06550128)研究显示出令人鼓舞的疗效和良好的安全性。
在本次AASLD2025大会公布的摘要中,进一步披露了这两项II期研究第48周的疗效结果。数据显示,在停止AHB-137治疗并继续维持核苷(酸)类似物治疗24周后,上述完全应答比例分别下降至22%和31%。此外,在第24周达到完全应答的患者中,仅有39%在48周时仍维持该应答状态。
6.贺普拉肽(Hepalatide)
大会上,上海贺普药业还公布了贺普拉肽(Hepalatide)的两项最新研究结果。
(1)Hepalatide与PEG-IFN的联合疗法可有效逆转HBeAg阳性CHB患者对干扰素的耐药性,提升抗病毒治疗效果。该研究结果支持进一步评估这一联合治疗策略,以改善以干扰素为基础的长期治疗结局。
(2)PEG-IFN可通过激活机体免疫促进cccDNA降解,而乙肝进入抑制剂则能通过阻断病毒新的感染,抑制cccDNA的补充。Hepalatide与PEG-IFN联合用药可显著降低患者肝内cccDNA水平,为清除乙肝病毒储存库提供了一种具有潜力的治疗策略。
7.BRII-179(VBI-2601)
BRII-179(VBI-2601)是由$腾盛博药-B(HK|02137)$腾盛博药开发用于慢性乙型肝炎治疗的新型治疗性乙肝疫苗,是一种基于重组蛋白质的新型HBV免疫治疗候选药物,由PreS1、PreS2和S乙型肝炎病毒(HBV)表面抗原组成,此前的临床试验结果表明BRII-179(VBI-2601)可诱导相当部分病毒抑制的慢乙肝患者产生强烈的功能性HBV特异性B细胞和T细胞免疫应答。2023年11月,中国国家药品监督管理局(NMPA)药品审评中心(CDE)授予BRII-179突破性疗法认定。
在2025年AASLD上腾盛博药发布了ENSUREII期研究最新突破性数据,进一步强调BRII-179作为慢乙肝治愈性疗法的潜力。研究显示,在BRII-179治疗后产生抗-HBs应答的参与者,在接受elebsiran联合PEG-IFN治疗时,持续HBsAg清除率明显更高。这些数据表明,BRII-179诱导的免疫反应可能有助于识别和选择更有可能从治愈性治疗中获益的患者群体。
二、乙肝新药未来展望:联合疗法成主流方向
医学界将乙肝治愈分为两种类型:功能性治愈(血清HBsAg清除)和灭菌性治愈(肝内cccDNA清除),后者被认为是乙肝治愈的最高标准,也是医学界长期追求的目标。
从本届AASLD大会发布的数据来看,乙肝治疗正经历从长期抑制向功能性治愈的历史性转变。GSK836、HH-003、ZM-H1505R、BRII-179等药物展现出前所未有的治愈潜力,而联合治疗策略则为实现更高治愈率提供了科学路径。
正如广生堂的“登峰计划”与腾盛博药的ENSURE研究所示,未来乙肝治疗可能趋向多机制药物联合使用,兼顾病毒抑制与免疫重建。随着2030年“消除病毒性肝炎”全球目标的临近,中国在乙肝新药研发中的角色日益凸显。从贺普拉肽的灭菌性治愈突破到AHB-137的持久应答,国产创新药正以“零时差”对接国际前沿,为全球数亿乙肝患者带来真正的治愈希望。
附:全球乙肝新药研发进展(截至2025年10月)


