据Choice数据统计,截至今日,沪深两市本周共514家上市公司接受机构调研。按行业划分,医药生物、电子和机械设备行业接受机构调研频度最高。此外,国防军工、纺织服饰等行业关注度有所提升。
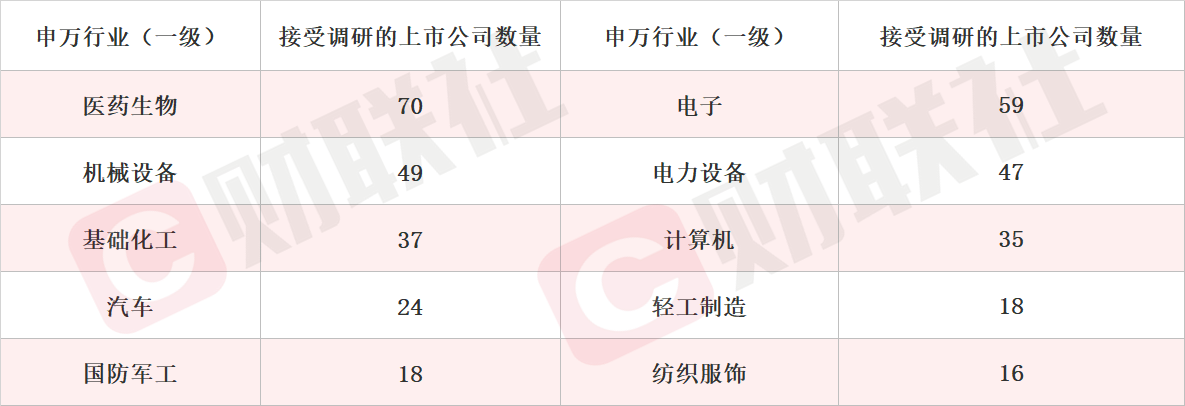
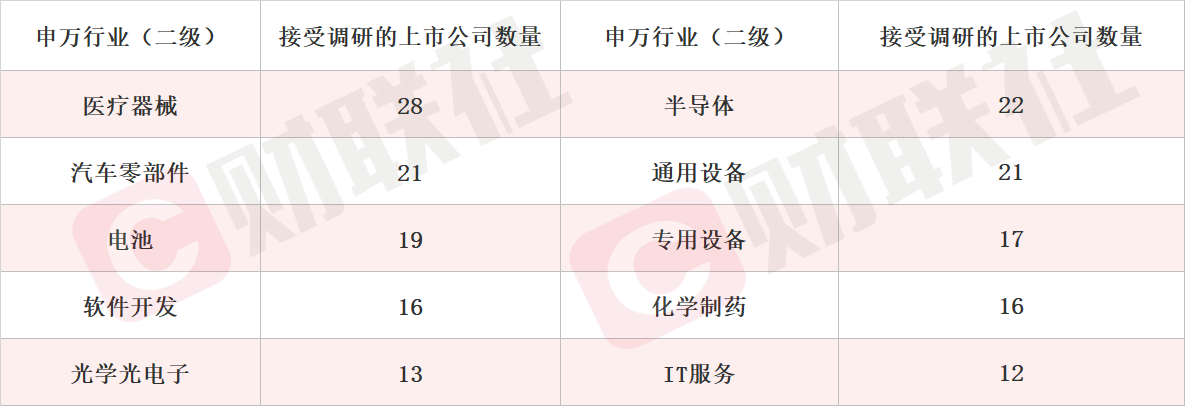
细分领域看,医疗器械、半导体和汽车零部件板块位列机构关注度前三名。此外,光学光电子、IT服务等行业机构关注度提升。
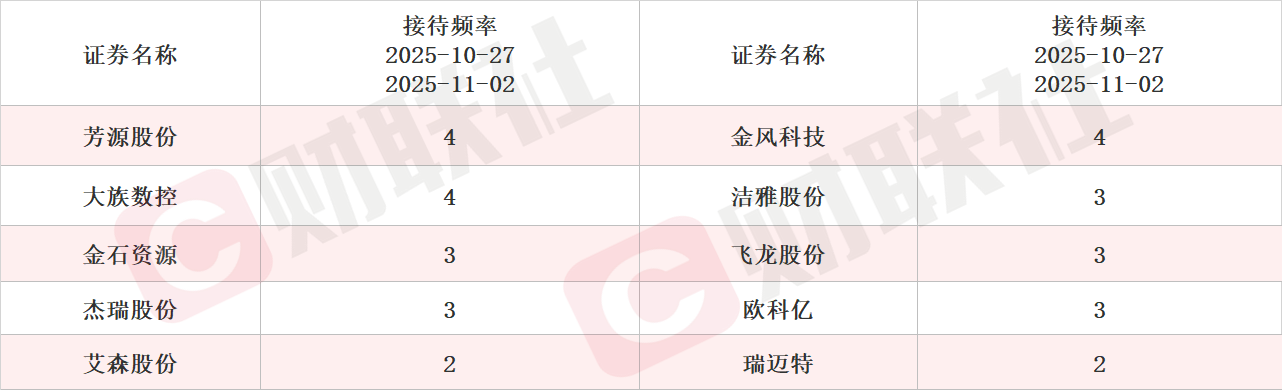
具体上市公司方面,据Choice数据统计,芳源股份、金风科技和大族数控接受调研次数最多,均达到4次。从机构来访接待量统计,兆易创新、金盘科技和蓝思科技排名前三,机构来访接待量分别达277家、254家和227家。
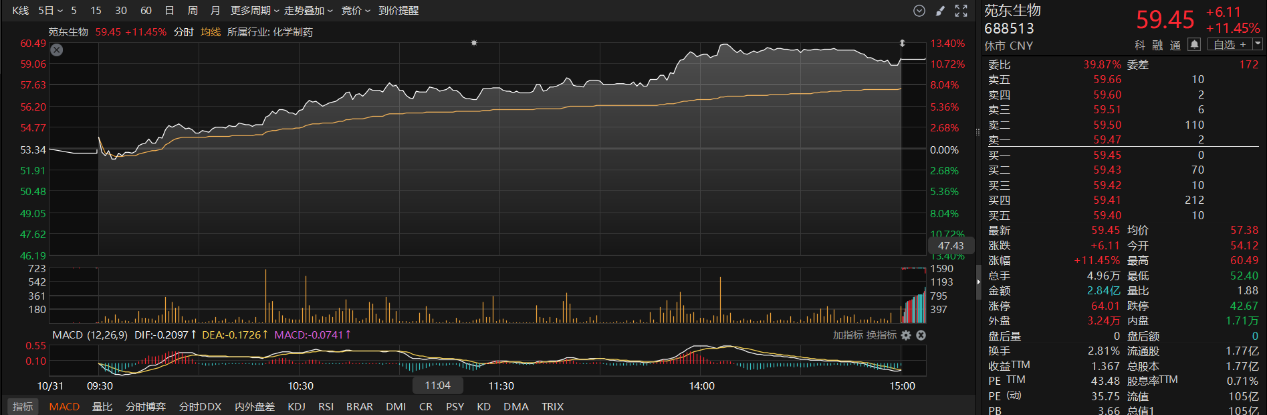
市场表现看,创新药概念股本周表现活跃。苑东生物周三发布机构调研纪要表示,公司ADC创新药研发管线中进展最快的是靶向组织因子(Tissue Factor)的抗肿瘤新药YLSH003,已于今年9月获得IND批准,适应症聚焦于晚期复发难治实体瘤,优先探索去势抵抗性前列腺癌(mCRPC),并计划拓展至宫颈癌、卵巢癌、胰腺癌等领域。目前,YLSH003Ⅰ期临床试验已正式启动。
二级市场上,苑东生物周五收盘涨超11%。
昂立康周四发布机构调研纪要表示,注射用ALK-N001/QHL-1618于2025年4月获得药物临床试验批准通知书,截至目前,正处于临床I期试验的剂量爬坡阶段,研发进程按照原定计划推进中;关于ALK-N002/IMD-1005项目,亚飞生物和亲合力仍在履行内部审批程序中。ALK-N002/IMD-1005是一种全球创新的肿瘤微环境激活型的IgG1亚型的靶向CD47的遮罩型抗体药物,有望为肿瘤患者提供新的免疫治疗选择。二级市场上,昂立康周五收盘涨停。
华东医药周三发布机构调研纪要表示,公司创新药研发中心正在推进90余项创新药管线项目。2025年至今,公司产品共获得5项上市批准。2025年10月全球首创新药瑞玛比嗪注射液国内上市许可申请正式获批;此前与其配套使用的经皮肾小球滤过率测量设备(TGFR)已于2025年2月获批,实现了全球首个适用于肾功能正常或受损患者的肾功能评估床旁产品“MediBeacon®TGFR”在中国市场的整体获批。此外,公司1类新药马来酸美凡厄替尼片(曾用名:迈华替尼片)已于2025年10月获批,用于具有表皮生长因子受体(EGFR)外显子21(L858R)置换突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
长春高新周四发布机构调研纪要表示,国内首款治疗急性痛风性关节炎1类创新生物制剂金蓓欣(伏欣奇拜单抗)2025年6月底获批后,7月中旬开始上市销售,目前销售情况良好,2025年第三季度已经实现销售收入超过5500万元。公司目前已搭建两百余人的销售团队,也在迅速提升医院、渠道等覆盖率。在研管线方面,全球首创超长效生长激素月制剂GenSci134,用于成人生长激素缺乏症的I期临床试验正在进行中,儿童生长激素缺乏症(PGHD)和非GHD(包括ISS等)适应症正在申报中。
阳光诺和周五发布机构调研纪要表示,在研创新药管线梯队中,目前进展最快的是“STC007注射液”,针对腹部手术后中、重度疼痛的II期临床试验已圆满达成预期目标,III期临床试验正按既定计划有序推进,该适应症公司已经与乐旷惠霖达成合作协议,合同里程碑付款累计总金额为2亿元(含税),合作方有多年阿片类大单品的销售经验,公司看好未来STC007上市后的商业化开发;此外,公司在多肽领域另一款产品“STC008注射液”也正在开展I期临床试验研究。该药物的主要适应症为治疗晚期实体瘤的肿瘤恶液质。目前FDA尚未批准任何药物用于肿瘤恶液质的治疗,该靶点国内癌症恶病质治疗领域尚为空白,此项目顺利推进有望实现国内该领域零的突破。
普蕊斯周四发布机构调研纪要表示,2025年前三季度,在政策持续支持、创新药企海外授权引进(BD)交易活跃及技术突破的多重驱动下,中国创新药行业进入高质量发展新阶段。尽管行业短期仍存在一定的竞争压力,但行业和客户需求呈现较好的复苏态势,2025年公司前三季度的询单量、新签订单同比实现较快增长。
健康元周三发布机构调研纪要表示,战略核心板块建设方面,目前已前瞻性布局超过10款呼吸领域1类创新药,形成差异化优势,重点管线推进均比较顺利。其中进度最靠前的是流感治疗的玛帕西沙韦胶囊,该产品已进入审评后期,公司正积极推进商业化各项准备,全力确保产品上市后顺利落地。这将成为健康元近年来首个获批的1类创新药,标志着公司创新转型正式进入收获期。
申联生物收盘发布机构调研纪要表示,近期公司及全资子公司本天成计划对世之源进行新一轮投资并取得世之源控股权。本次控股权收购事项计划于2025年底之前完成。注册资本20亿元的战略投资者央扶基金基于看好世之源的艾滋病新药等创新药管线而投资世之源,未来公司与摩尼肽、央扶基金等股东携手共同推进艾滋病单抗等多个创新药的研发及上市,努力实现合作共赢。
以岭药业周三发布机构调研纪要表示,截至到报告期末,公司有4个创新药品种进入临床阶段,多个创新药处于临床前研究阶段,其中苯胺洛芬注射液申报NDA已获受理,治疗急性髓性白血病的XY0206片的处于三期临床,治疗缺血性脑卒中的XY03-EA片和适应症为辅助生殖的G201胶囊处于II期临床。今年4月,公司首个化学原料药-来曲唑上市申请获批,截止到报告期内末,公司有多个原料药产品在国内申报注册中。
康弘药业周三发布机构调研纪要表示,关于研发进展,KH902-R10(高剂量康柏西普眼用注射液治疗糖尿病黄斑水肿(DME))目前处于临床Ⅱ期阶段;基因治疗板块的KH631及KH658目前中国均处于临床Ⅱ期阶段,美国均处于临床I期阶段;合成生物技术板块的KH617(治疗晚期实体瘤(包括成人弥漫性胶质瘤))处于临床Ⅱ期阶段;抗体偶联药物KH815(治疗多种晚期实体瘤)中国、澳大利亚均处于临床Ⅰ期阶段;中成药板块的KH110(治疗阿尔茨海默症(Alzheimersdisease,AD))处于临床III期阶段,KH109(舒肝解郁胶囊新增焦虑症)处于临床III期阶段;小分子创新药板块的KH607(治疗抑郁症)处于临床II期阶段,KHN702(治疗急性疼痛)处于临床I期阶段。

