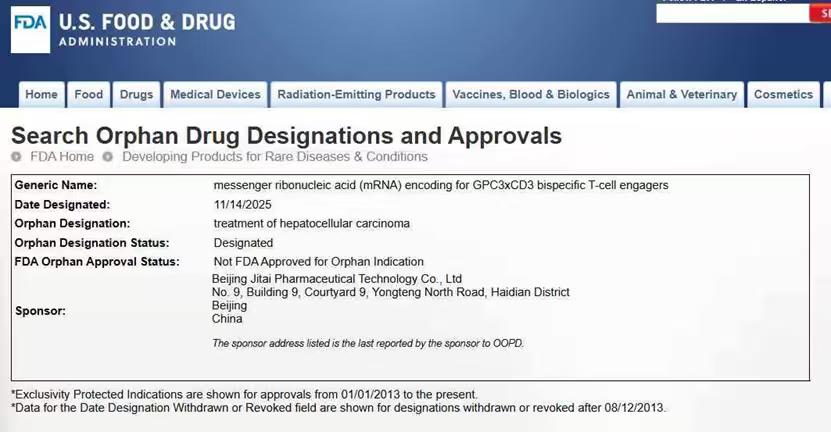
12月15日,国际期刊《自然·通讯》发表了剂泰科技MTS-105在肝细胞癌治疗领域最新研究成果。研究显示,mRNA编码的双特异性抗体T细胞衔接器在肝细胞癌小鼠模型中实现了肿瘤细胞完全清除并诱导长期T细胞免疫记忆,有望成为全球首款mRNA编码T细胞连接器(TCE)实体瘤疗法。

据介绍,基于T细胞连接器(TCE)的免疫疗法已在血液肿瘤中经过广泛临床验证,然而,其在实体瘤中的应用面临诸多障碍,包括T细胞浸润、免疫抑制性肿瘤微环境及系统性毒性风险。团队开发的MTS-105采用“特洛伊木马”策略,摒弃全身攻击的传统疗法,通过精准靶向肝细胞GPC3的脂质纳米颗粒,在实体瘤内部和其周围大规模生成并释放TCE,有效激活T细胞对肿瘤细胞实施杀伤,显著提升局部药效并优化了药代动力学特性。
在小鼠、大鼠和食蟹猴模型中,相较传统疗法,MTS-105展现出高度组织特异性和出色的安全性,大幅减少系统性毒性风险。如在小鼠模型中,在低至0.15微克的剂量下,实验小鼠实现肿瘤完全清除,且治愈小鼠再次接种新肿瘤后仍保持无瘤状态,显示出长期免疫记忆效应,有效防止肿瘤复发。
论文显示,借助剂泰科技自研的AI纳米递送平台人工智能平台,团队设计了高效递送系统,同时在mRNA序列设计时取得最佳平衡,显著提高mRNA的翻译效率及稳定性。
此前,该团队在《癌症免疫治疗杂志》发表了创新型mRNA治疗性疫苗的研究成果,也是通过精准靶向递送技术,将疫苗递送至脾脏,显著提升抗原递呈效率。同时,双亚型、多靶点智能安全的抗原设计,显著提升抑瘤药效,有效地激活对人乳头瘤病毒特异性的CD8+T细胞。
论文通讯作者、剂泰科技首席科学官徐伟博士表示,一直以来,mRNA类核酸药物的治疗性应用始终面临瓶颈,其突破重点在于mRNA递送载体的创新。通过靶向递送系统将药物送进致密的实体瘤内部将大大提升治疗有效性。当前,此次论文报道的肝细胞癌治疗候选药物已获得美国食品药品监督管理局的孤儿药资格认定。