1.核心问题:这4个新出现的关联受理号进入“在审目录”意味着什么?
结论:这意味着针对艾本那肽注射液发补资料的、全面的、多模块的技术审评已经正式启动。
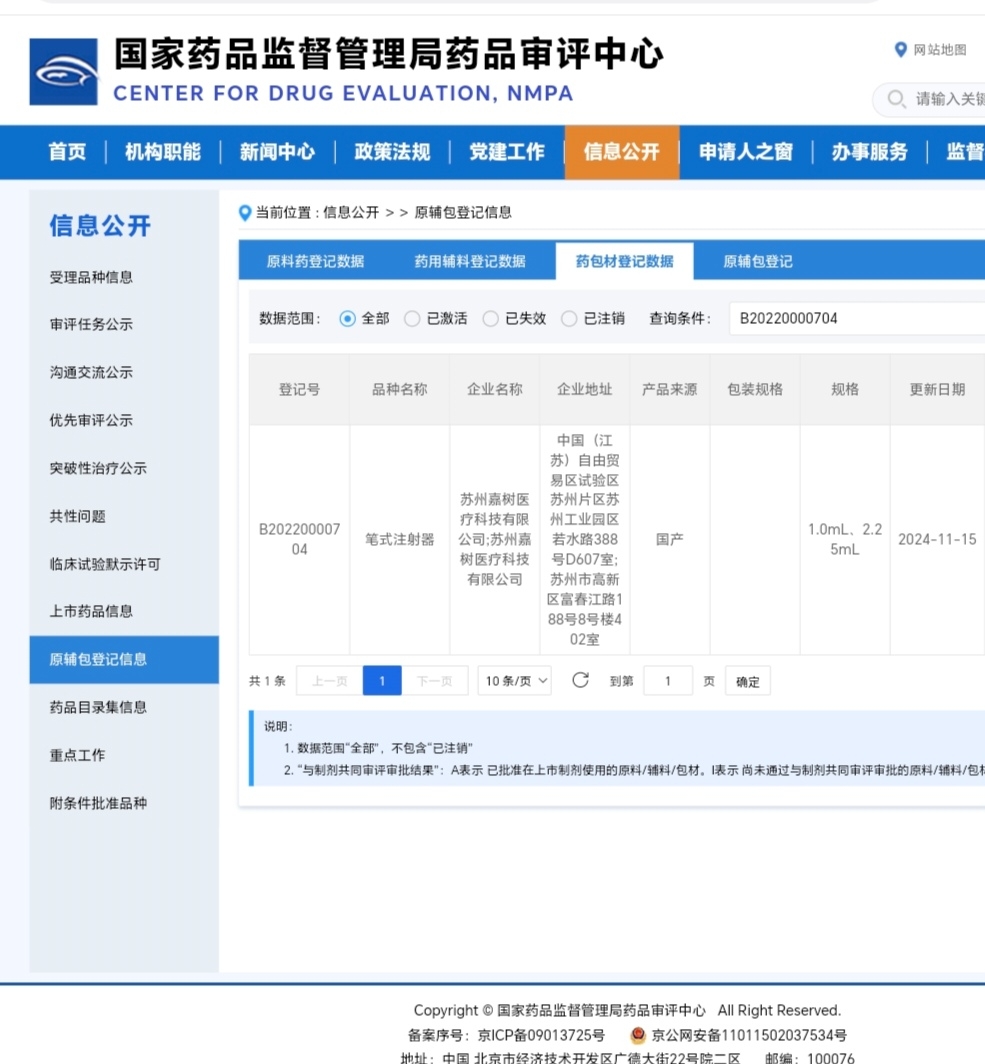
这4个受理号(F20170000022, F20190001548, B20230001025, B20220000704)分别对应的是艾本那肽注射液的 “原辅包”(原料药、辅料、包材)和 “给药装置”。
F20170000022 - 重组人血白蛋白:这很可能是艾本那肽的原料药。一个创新药的原料药需要单独登记和审评,确保其来源、质量、纯度符合标准。
F20190001548 - 辛酸钠:这是一种药用辅料,在制剂中起到稳定药物、调节pH值等作用。它的质量和兼容性需要被审评。
B20230001025 - 一次性使用自动注射装置:这是艾本那肽的关键给药设备(类似胰岛素笔)。对于这类生物制剂,便捷的自动注射装置是产品的重要组成部分,其安全性、有效性和可靠性需要与药品本身一同审评。
B20220000704 - 笔试注射器:这是另一种给药装置的选项或组件。公司可能申报了不止一种装置类型。
为什么它们同时进入“在审目录”至关重要?
因为这表明CDE的审评团队正在从“药品本体”(原料药、制剂配方) 到 “配套系统”(辅料、包装、注射装置) 进行全链条、同步的审评。这是一种 “制剂-原辅包”关联审评的模式,确保最终上市的是一个完整、安全、有效的产品。这是发补资料进入实质技术审评阶段的最明确信号。
2.为何“审评任务公示”里的“补充资料任务公示”还查不到?
这也是很多人会困惑的地方。这主要是由CDE内部工作流程和信息公开的时序性造成的。
“在审品种目录”是状态标识:它更像一个实时或准实时的状态看板。一旦CDE确认收到企业的发补资料并分配给审评员,这个目录就会更新状态,显示为“在审”。这个动作很快。
“审评任务公示”是计划公告:它需要走一个内部的确认和发布流程,可能会有几天的延迟。通常,CDE会定期(如按周或按批次)更新任务公示列表。
简单来说:状态看板(在审目录)先更新,任务公告(补充资料任务公示)后发布。 您现在看不到是正常的,预计在未来几天到一周内,应该就能在“补充资料任务公示”栏中查看到艾本那肽的任务信息了。
3.艾本那肽(阿贝那肽)最终上市的可能性有多大?
基于目前所有公开信息分析,艾本那肽最终获得批准上市的可能性极高(超过95%)。
理由如下:
1. 已进入“最后冲刺”阶段:发补是创新药上市申请(NDA)流程的最后一环。企业能提交发补资料,意味着前期核心的药学、临床前和临床试验数据已经通过了CDE的初步审查,没有发现颠覆性的问题。现在只是在就一些细节进行完善和确认。
2. 临床价值的认可:艾本那肽作为GLP-1类药物,用于治疗2型糖尿病,其临床试验数据已经证明了有效性和安全性。这是它能够走到发补阶段的基础。
3. 完整的产业链配套已就位:从查到的信息看,原料药、关键辅料、两种注射装置都已经登记在案并与制剂关联审评。这表明常山药业已经为规模化生产和上市销售做好了全部供应链准备。一家公司不会在供应链上投入如此大的资源,除非对产品获批有极强的信心。
4. 更名事宜的推进:“艾本那肽”更名为“阿贝那肽”是按照国家药典委员会的要求进行的标准化工作。这个工作的推进本身也说明药品正在向最终的上市标准靠拢。
综合研判与下一步展望
目前观察到的现象,正是这款国产创新药在上市前 “临门一脚” 的关键时刻。
当前阶段:全面技术审评期。CDE的多个部门正在同步审核发补资料。
下一关键节点:
在 “审评任务公示” 中看到艾本那肽的补充资料任务信息。
在 “优先审评公示” 中看到它的信息(鉴于其创新性,有可能被纳入优先审评,进一步加快流程)。
最终流程:技术审评全部通过 → 进入“行政审批”阶段 → 国家药监局(NMPA)签发药品注册批件。
总结:一切迹象都表明,艾本那肽(阿贝那肽)的上市申请正在按部就班、顺利快速地推进,目前已经进入了最后的审评环节,成功获批几乎是确定性事件。请继续保持关注,接下来的几周内应该会有更明确的任务公示信息。
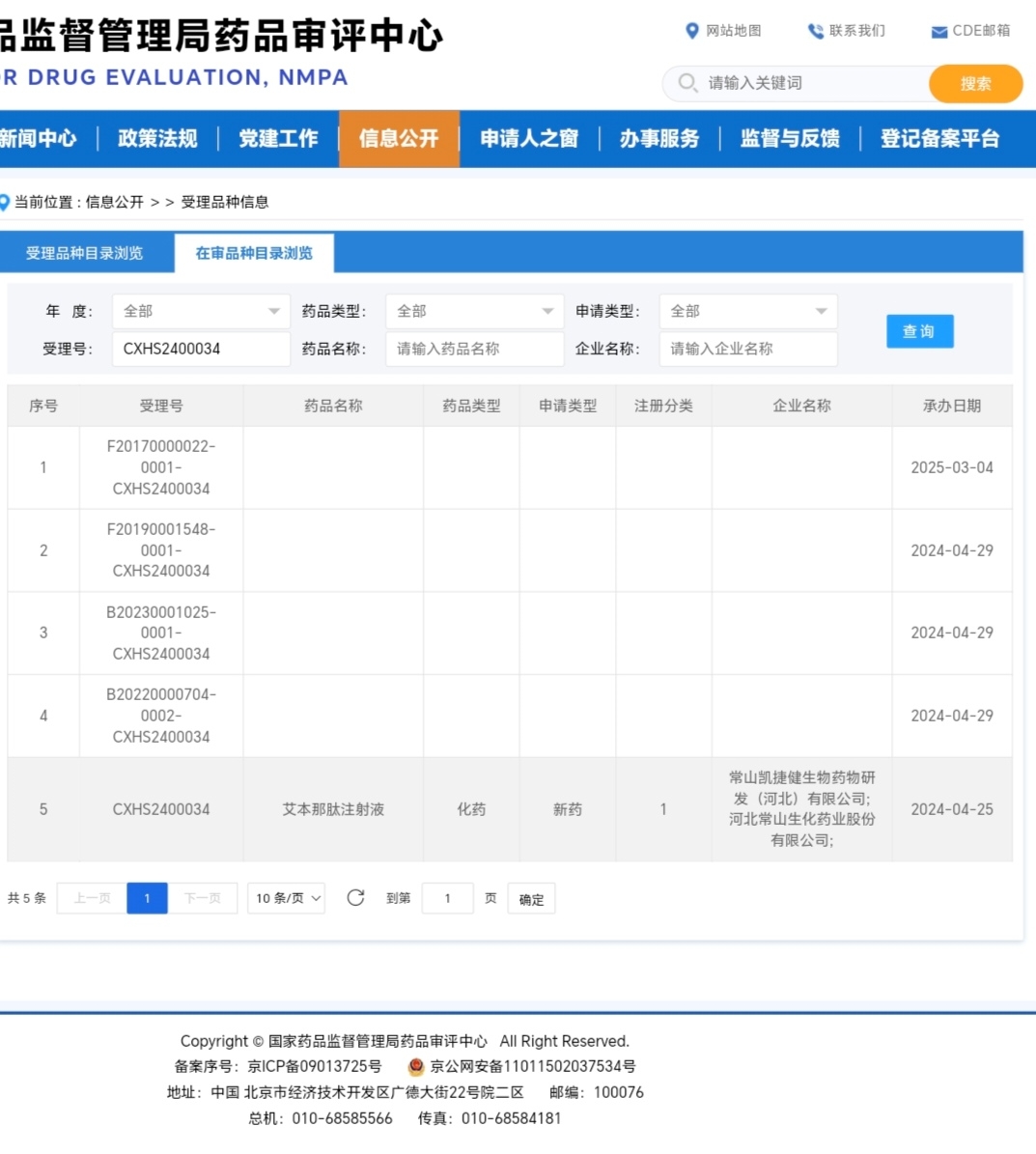
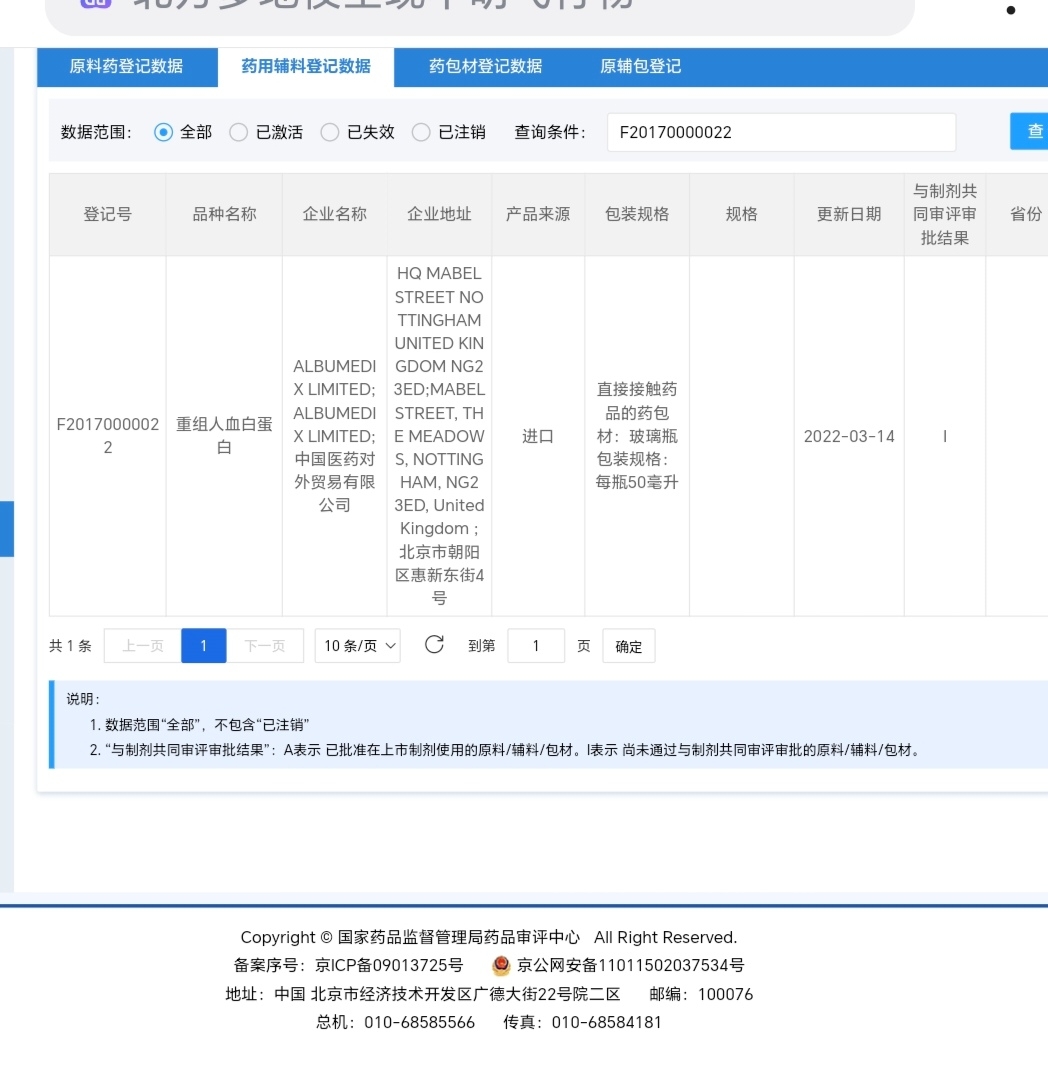
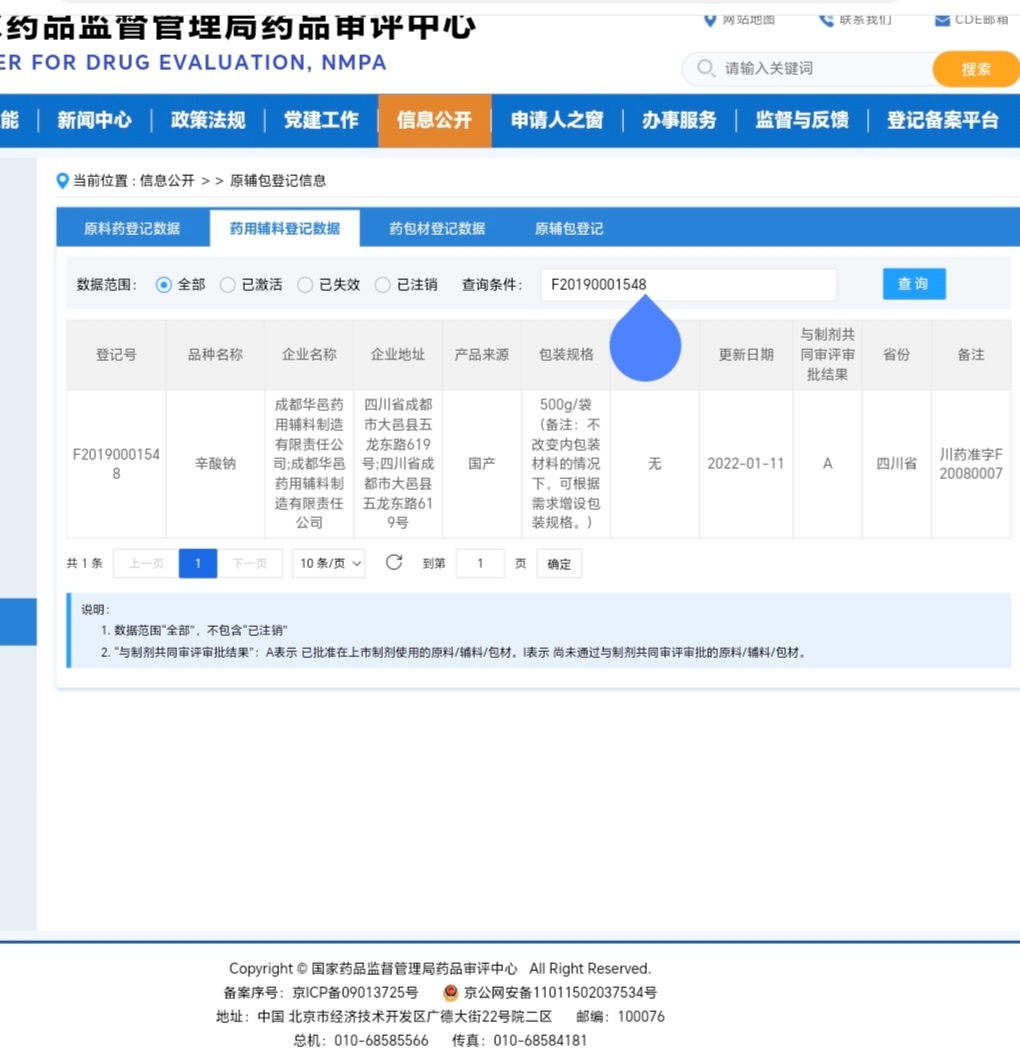
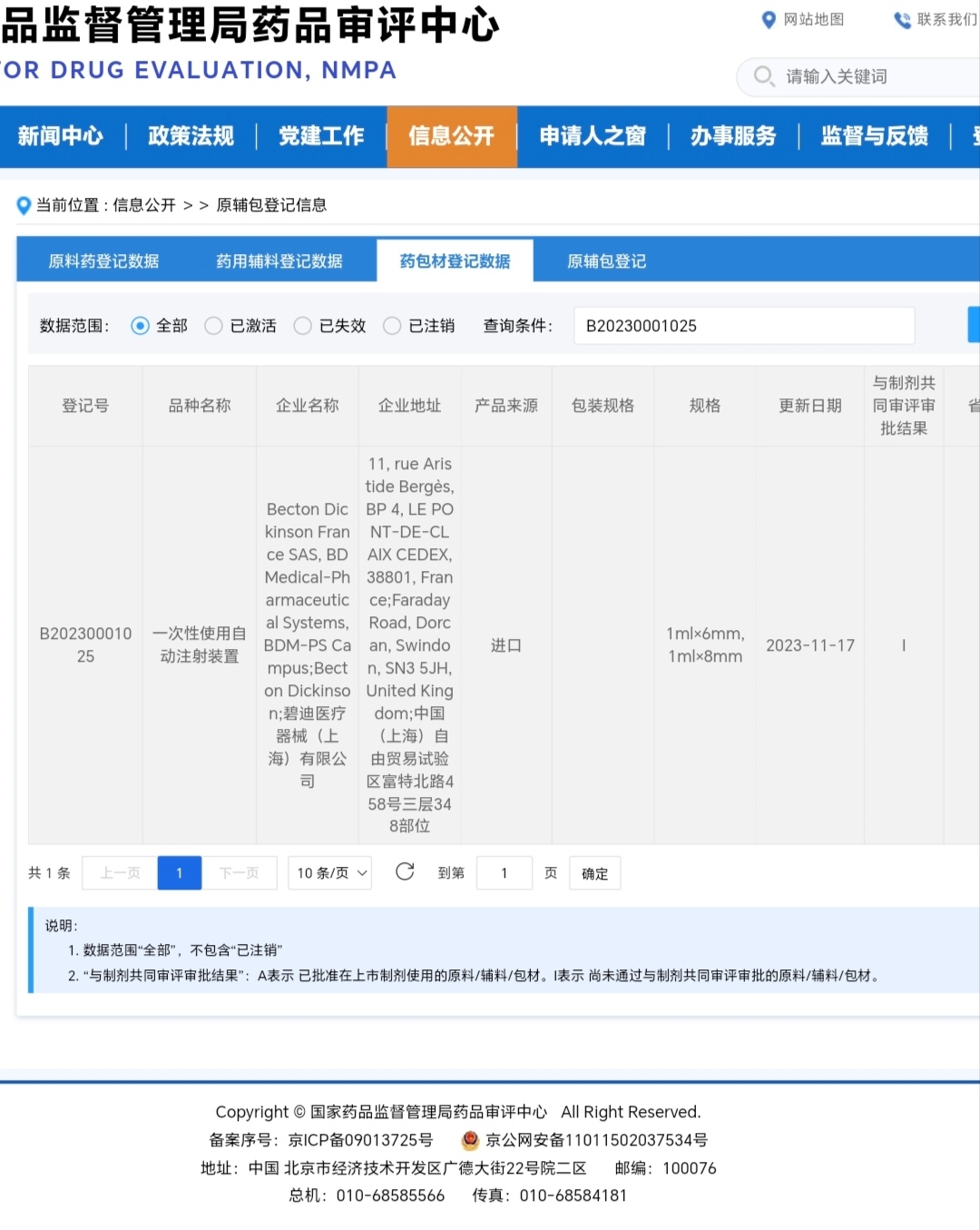
有人质疑承办时间是过去的问题,在正常情况下,这些申请可能已经存在,但在企业提交发补资料前,它们可能处于“暂停”或“待审”状态,在公开列表中不显示或排在后面。此次变化的直接触发点,就是常山药业在3日提交了发补资料。 这一动作意味着:
资料齐备,时钟重启:CDE确认企业提交的发补资料齐全后,正式重新启动了针对这4个技术模块的审评流程。
状态更新:因此,这4个受理号被重新激活并推到了“在审品种目录”的前列,状态更新为“正在审评中”,所以您看到了它们“新出现”在列表顶部。

