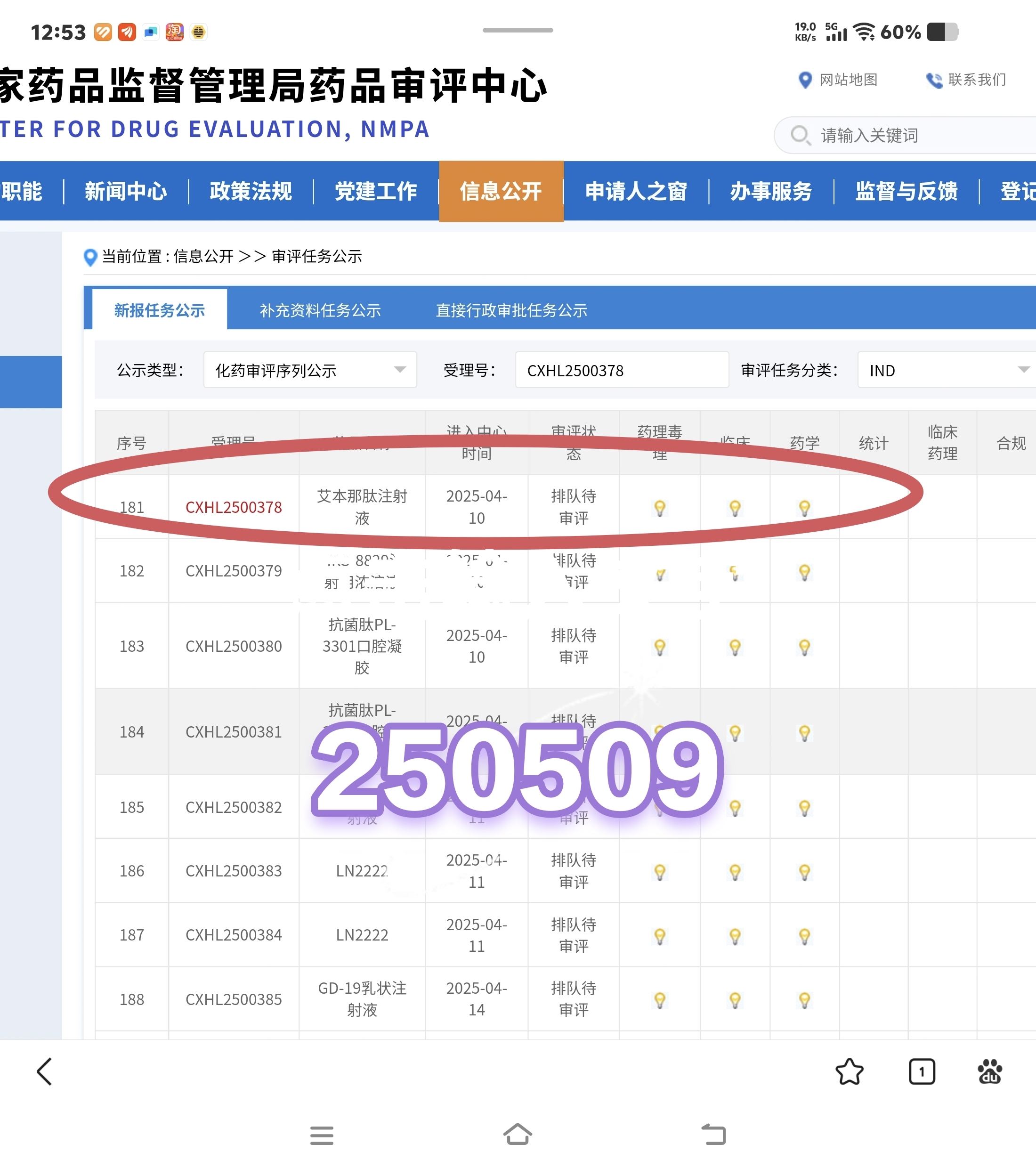
评审“CXHL”(国产新药化学药品临床申请)的流程如下:
提出申请:申请人向药品监督管理部门提出申请。如果是两个以上单位共同作为申请人,向其中药品生产企业所在地省、自治区、直辖市药监部门提出申请;申请人均为药品生产企业,向申请生产制剂的药品生产企业所在地省、自治区、直辖市药监部门提出申请;申请人均不是药品生产企业,向样品试制现场所在地省、自治区、直辖市药监部门提出申请。同时,申请人要对申请注册的药物相关信息及专利情况进行说明。
受理审查:省、自治区、直辖市药监部门对申请材料进行审查,符合要求的出具《药品注册申请受理通知书》,不符合要求的出具《药品注册申请不予受理通知书》。
临床前研究审查:药监部门组织检验,联合相关单位出具意见,报国家药监局。若符合要求,发给《药物临床试验批件》;不符合要求则出具《审批意见通知书》,并说明理由。
开展药物临床试验:申请人在批准后三年内组织药物临床试验,试验包括一期、二期、三期、四期和生物等效性试验。
临床试验完成后申报:临床试验完成后,申请人向国家药监局提供临床试验总结报告、统计分析报告及数据库。之后填写《药品注册申请表》,报省、自治区、直辖市药监部门。
综合评审:国家药监局评审中心依据技术审评意见、样品生产现场检查报告和样品检验结果,形成综合意见,报国家药监局审批。最终,国家药监局根据综合意见作出审批决定,符合规定的发给相关批准文件,不符合的发给《审批意见通知书》,并说明理由。
这个还早呢
提出申请:申请人向药品监督管理部门提出申请。如果是两个以上单位共同作为申请人,向其中药品生产企业所在地省、自治区、直辖市药监部门提出申请;申请人均为药品生产企业,向申请生产制剂的药品生产企业所在地省、自治区、直辖市药监部门提出申请;申请人均不是药品生产企业,向样品试制现场所在地省、自治区、直辖市药监部门提出申请。同时,申请人要对申请注册的药物相关信息及专利情况进行说明。
受理审查:省、自治区、直辖市药监部门对申请材料进行审查,符合要求的出具《药品注册申请受理通知书》,不符合要求的出具《药品注册申请不予受理通知书》。
临床前研究审查:药监部门组织检验,联合相关单位出具意见,报国家药监局。若符合要求,发给《药物临床试验批件》;不符合要求则出具《审批意见通知书》,并说明理由。
开展药物临床试验:申请人在批准后三年内组织药物临床试验,试验包括一期、二期、三期、四期和生物等效性试验。
临床试验完成后申报:临床试验完成后,申请人向国家药监局提供临床试验总结报告、统计分析报告及数据库。之后填写《药品注册申请表》,报省、自治区、直辖市药监部门。
综合评审:国家药监局评审中心依据技术审评意见、样品生产现场检查报告和样品检验结果,形成综合意见,报国家药监局审批。最终,国家药监局根据综合意见作出审批决定,符合规定的发给相关批准文件,不符合的发给《审批意见通知书》,并说明理由。
这个还早呢
郑重声明:用户在财富号/股吧/博客等社区发表的所有信息(包括但不限于文字、视频、音频、数据及图表)仅代表个人观点,与本网站立场无关,不对您构成任何投资建议,据此操作风险自担。请勿相信代客理财、免费荐股和炒股培训等宣传内容,远离非法证券活动。请勿添加发言用户的手机号码、公众号、微博、微信及QQ等信息,谨防上当受骗!
评论该主题
帖子不见了!怎么办?作者:您目前是匿名发表 登录 | 5秒注册 作者:,欢迎留言 退出发表新主题
郑重声明:用户在社区发表的所有资料、言论等仅代表个人观点,与本网站立场无关,不对您构成任何投资建议。用户应基于自己的独立判断,自行决定证券投资并承担相应风险。《东方财富社区管理规定》