




重磅!全球首款TCR-T细胞疗法获批上市!肿瘤缩小81%!
首款用于治疗实体瘤的工程化T细胞疗法(TCR-T)Afamitresgene autoleucel成功获得美国食品药品监督管理局(FDA)的批准用于治疗既往接受过化疗的不可切除或转移性滑膜肉瘤成人患者。
2024年8月1日,首款用于治疗实体瘤的工程化T细胞疗法(TCR-T)Afamitresgene autoleucel成功获得美国食品药品监督管理局(FDA)的批准用于治疗既往接受过化疗的不可切除或转移性滑膜肉瘤成人患者。

此次批准主要基于SPEARHEAD-1 (队列1)的试验结果,该试验共纳入44例滑膜肉瘤患者,总缓解率为43%,中位缓解持续时间(DOR)为半年,缓解持续时间至少1年的患者有39%。
SPEARHEAD-1的I期临床试验中,有2例滑膜肉瘤患者在TCR-T细胞疗法Afami-cel治疗6周后均实现部分缓解(PR),肿瘤病变分别缩小了45%和81%。
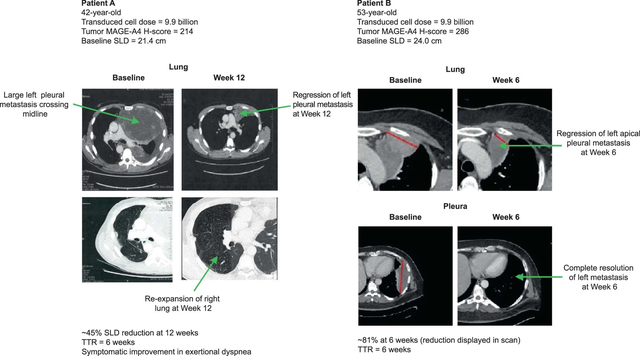
T细胞受体工程化T细胞(TCR-T)疗法不受靶细胞表面抗原表达的限制,是一种潜在的癌症治疗细胞免疫疗法。TCR-T疗法目前已在肝细胞癌、宫颈癌、巢癌、肺癌等实体瘤领域取得突破性成就。
TCR-T细胞产品TAEST16001实现脂肪肉瘤患者缓解超1年!
2024年7月30日,国家药品监督管理局药品审评中心(CDE)将TCR-T细胞产品TAEST16001注射液纳入突破性治疗品种名单,标志着该产品作为中国第一个IND获批开展临床试验的TCR-T细胞治疗新药取得重大突破,有望成为中国第一款上市的TCR-T细胞治疗药物。
截图来源于国家药品监督管理局药品审评中心
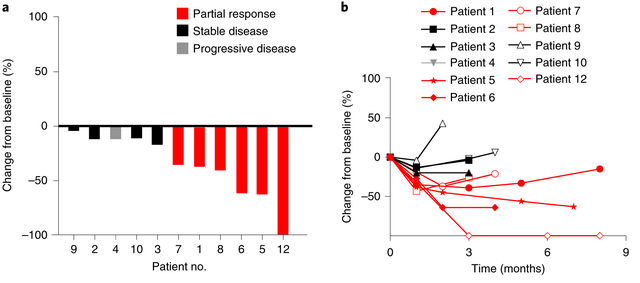
2022年美国临床肿瘤学会(ASCO)公布TAEST16001治疗晚期软组织肉瘤患者I期临床试验的数据结果。该试验共入组12例晚期软组织肉瘤患者,其中有10例滑膜肉瘤患者,2例脂肪肉瘤患者。结果显示:5例患者实现部分缓解(PR),5例患者病情稳定(SD),疾病控制率(DCR)为83.3%,中位无进展生存期(PFS)为7.2个月,中位缓解持续时间(DOR)为14.1个月。
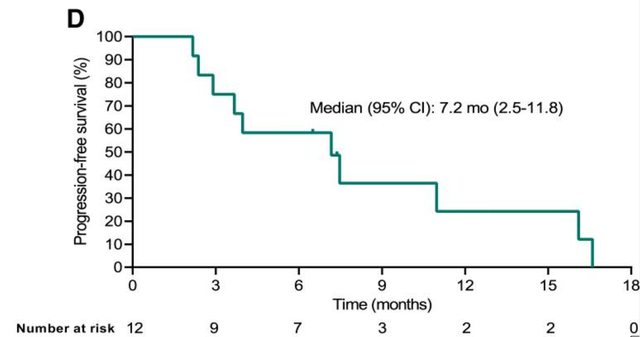
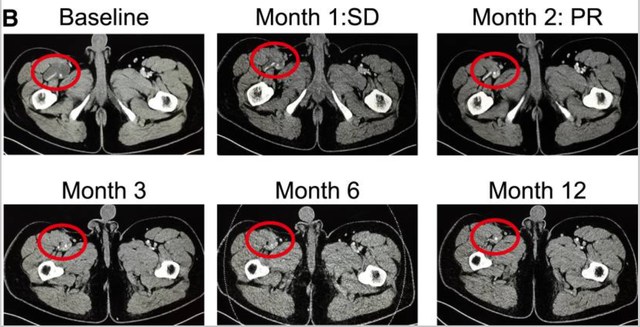
值得注意的是,该试验中1例脂肪肉瘤患者,在TCR-T细胞TAEST16001治疗后实现部分缓解,并持续缓解超1年!
在2024年美国临床肿瘤学会(ASCO)上,TCR-T细胞疗法TAEST16001公布了它在晚期软组织肉瘤(STS)中的II期临床数据(NCT05549921)。共有8例软组织肉瘤患者入选,结果显示:4例患者实现部分缓解(PR),3例患者病情稳定(SD),客观缓解率(ORR)为50%,该缓解率远超预期疗效!
TCR-T细胞疗法治疗肝细胞癌
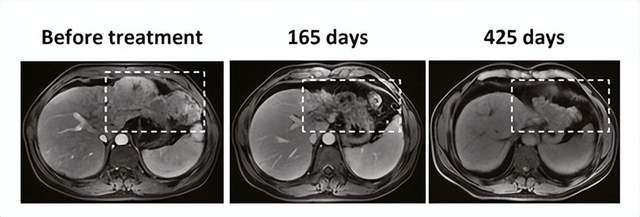
在I期NCT03899415临床试验中,共纳入8例乙型肝炎病毒(HBV)肝细胞癌患者,中位总生存期(OS)为33.1个月,将近3年!
其中1例患者在治疗165天后,肿瘤显著坏死,425 天后,肿瘤明显减小。
TCR-T细胞疗法治疗HPV病毒相关上皮癌
2021年2月,国际顶级期刊《Nature》发表了靶向 HPV-16 E7 的TCR-T细胞疗法治疗转移性人瘤病毒相关上皮癌的临床试验(NCT02858310)数据。该试验12例患者中有一半的患者实现部分缓解(PR)。
香雪生命科学具有自主知识产权的TCR核心技术,拥有完整的TCR-T产品研发技术体系和生产制备体系,其中TCR-T产品研发技术体系包含:抗原肽发现平台,TCR高亲和力平台,TCR-T开发平台;TCR-T生产制备体系包含:自动化细胞生产平台,质控平台;已形成了TCR-T细胞产品全链条创新产业链。
香雪生命科学TCR-T产品和储备管线布局广泛,靶点丰富涉及包括CT抗原,新生抗原,病毒抗原等几乎所有与肿瘤相关的特异性抗原,涵盖A0201,A1101及A2402等多个以中国人群居多的HLA基因型,适应症覆盖多种临床难治的实体瘤,处于国际领先水平。
TAEST16001有望成为中国首个上市的TCR-T细胞治疗产品,不仅填补了软组织肉瘤这一高致死率难治性肿瘤的临床治疗空白,更推动了中国细胞治疗产业与国际前沿接轨,成为生物医药新质生产力的标杆。TAEST16001作为全球第二款冲击实体瘤的TCR-T疗法,其适应症已拓展至食管癌、非小细胞肺癌等恶性肿瘤,如开发成功,后期市场空间巨大,将以低毒性和好疗效重塑癌症治疗的新格局。2025年3月30日TAEST16001治疗晚期软组织肉瘤的确证性临床试验方案专家研讨会在广州召开 。
此次TCR-T疗法Afami-cel成功获批上市,是TCR-T细胞疗法在实体瘤领域的重要里程碑!Afami-cel的获批必然激发国内企业的"战斗力",相信在不久之后,会有更多TCR-T细胞疗法产品获批上市,让患者有更加精准、多样的治疗选择!

