胼胝体(corpus callosum)是哺乳动物特有的连接左右大脑半球的神经纤维束,其发育与功能是神经科学与进化研究的经典课题。以下从发育时序、分子机制、调控基因及跨物种对比四方面展开,结合最新进展解析其奥秘。
一、胼胝体的发育时序:从胚胎到成熟的精密调控
哺乳动物胼胝体发育遵循严格的时空规律(以人类为例):
1. 胚胎期(7-12周):终板(端脑中线结构)背侧增厚形成连合板(commissural plate),为连合纤维提供初始支架;前连合(连接嗅球与颞叶)与海马连合(连接海马)率先发育。
2. 胎儿期(12-20周):端脑正中沟裂开,胶质细胞聚集形成“胼胝体悬带”(subcallosal sling),分泌Netrin-1引导首批轴突(来自扣带回皮层)跨越中线,形成胼胝体膝部(genu)和体部前段(anterior body);随后纤维由前向后延伸,压部(splenium)最后形成,厚度达1-2mm。
3. 出生后(0-青春期):纤维数量快速增长(成人约2亿根),髓鞘逐渐增厚;其中压部髓鞘化早于膝部(Pujol et al., 2019),这一“逆向成熟”模式与青少年逻辑推理能力发展同步,确保高级认知功能逐步完善。
二、形成机制:细胞支架与分子导向的协同作用
胼胝体纤维跨越中线的精确性依赖胶质细胞支架与分子导向因子的精密协作:
1. 胶质细胞支架:
- 胼胝体悬带:由放射状胶质细胞分化而来,形成物理桥梁,分泌Netrin-1(趋化因子)引导先驱纤维(扣带回纤维)率先跨越中线。
- 灰质被盖(indusium griseum):覆盖于胼胝体上方的胶质细胞层,分泌Slit-2(排斥因子),与轴突表面的Robo受体结合,防止纤维偏离中线路径。
2. 分子导向系统:
- Netrin-1/DCC信号:Netrin-1由悬带胶质细胞分泌,与轴突表面的DCC受体结合,驱动先驱纤维向中线定向生长。
- Slit-2/Robo信号:Slit-2由灰质被盖胶质细胞分泌,与轴突表面的Robo受体结合,产生排斥力,约束纤维在正确通道内延伸。
- 细胞骨架调控:轴突内的微管(由TUBB3等基因编码)和肌动蛋白动态变化,驱动生长锥(growth cone)沿导向因子梯度定向延伸。
三、调控基因:从神经导向到全局发育的网络
胼胝体发育受多基因网络调控,涵盖神经导向、细胞迁移、轴突生长等环节:
- 核心神经导向基因:
- NETRIN1:编码Netrin-1蛋白,调控先驱纤维的中线导向;NETRIN1突变与胼胝体发育不全(ACC)相关。
- SLIT2/ROBO1:SLIT2编码排斥因子,ROBO1为其受体;SLIT2突变会导致纤维束偏离,引发胼胝体发育异常。
- 细胞骨架调控基因:
- LIS1(PAFAH1B1):编码细胞骨架调节蛋白,参与微管稳定性和神经元迁移;LIS1突变导致“无脑回畸形”(lissencephaly),常伴胼胝体发育不全。
- DCX(Doublecortin):编码微管结合蛋白,促进神经元迁移和轴突生长;DCX突变导致“双皮质综合征”(double cortex),胼胝体发育异常并伴随皮层分层紊乱。
- 脑区模式形成基因:
- HOXB1:在小鼠中,Hoxb1^-/-突变可导致终板缩小,直接影响胼胝体前体细胞的增殖与迁移,提示其在起始区定位中的关键作用(Chiang et al., 1996)。
- 临床关联疾病:
- Aicardi综合征(X连锁显性):核心致病基因为X染色体上的AICARD基因(OMIM 300895),编码含核定位信号的蛋白;部分病例合并其他基因异常,表现为胼胝体完全缺失、视网膜发育不良和癫痫。
- 爱德华氏综合征(Edwards syndrome,18三体综合征):染色体异常导致胼胝体发育不良,常伴智力障碍和运动缺陷。
四、跨物种对比:胼胝体的进化与替代结构
胼胝体是哺乳动物的标志性结构,但其功能在非哺乳动物中由更原始的连合系统替代,反映了脑连接的演化保守性与创新性(表1)。
表1 跨物种连合结构与功能对比
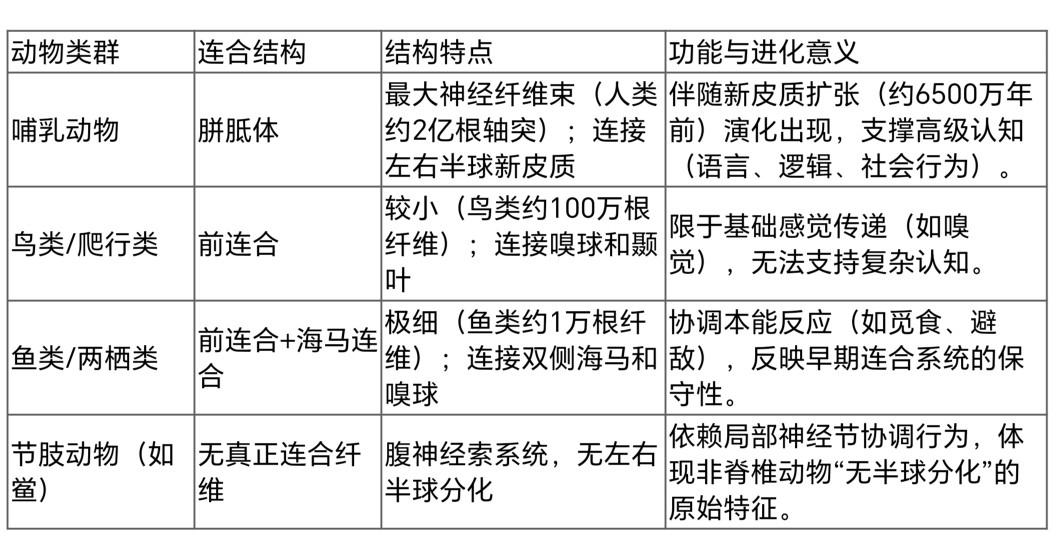
总结:科学与进化启示
胼胝体是哺乳动物认知能力的基石,其发育依赖胶质支架、分子导向与多基因网络的协同。跨物种比较揭示,胼胝体是脑进化中“功能需求驱动结构创新”的产物——随着新皮质扩张(约6500万年前),胼胝体逐步演化以支持更复杂的信息整合需求。未来研究需进一步探索表观遗传(如DNA甲基化)对胼胝体发育的调控机制,以及其异常与神经发育障碍(如自闭症、精神分裂症)的关联,为相关疾病治疗提供新靶点。

