奥司他韦精准抑制流感病毒,索磷布韦实现丙肝临床治愈,依福格雷(CG-0255)在抗血小板治疗中显示出独特潜力——这些医学突破背后,一种名为“前药”的技术正逐渐走入公众视野。
通过化学修饰让药物“伪装”穿越生物屏障、在靶区精准释放,这项技术已从最初优化药代动力学的辅助工具,演变为药物研发的核心策略之一。
在前药技术的迭代进程中,何公欣博士的轨迹颇具代表性。这位曾参与吉利德多款重要前药研发的科学家,2018年在上海创立柯君医药,尝试以“AI+空间化学”探索新一代前药技术。这一个人职业转向的背后,折射出中国创新药企在全球前药研发领域的突围尝试。
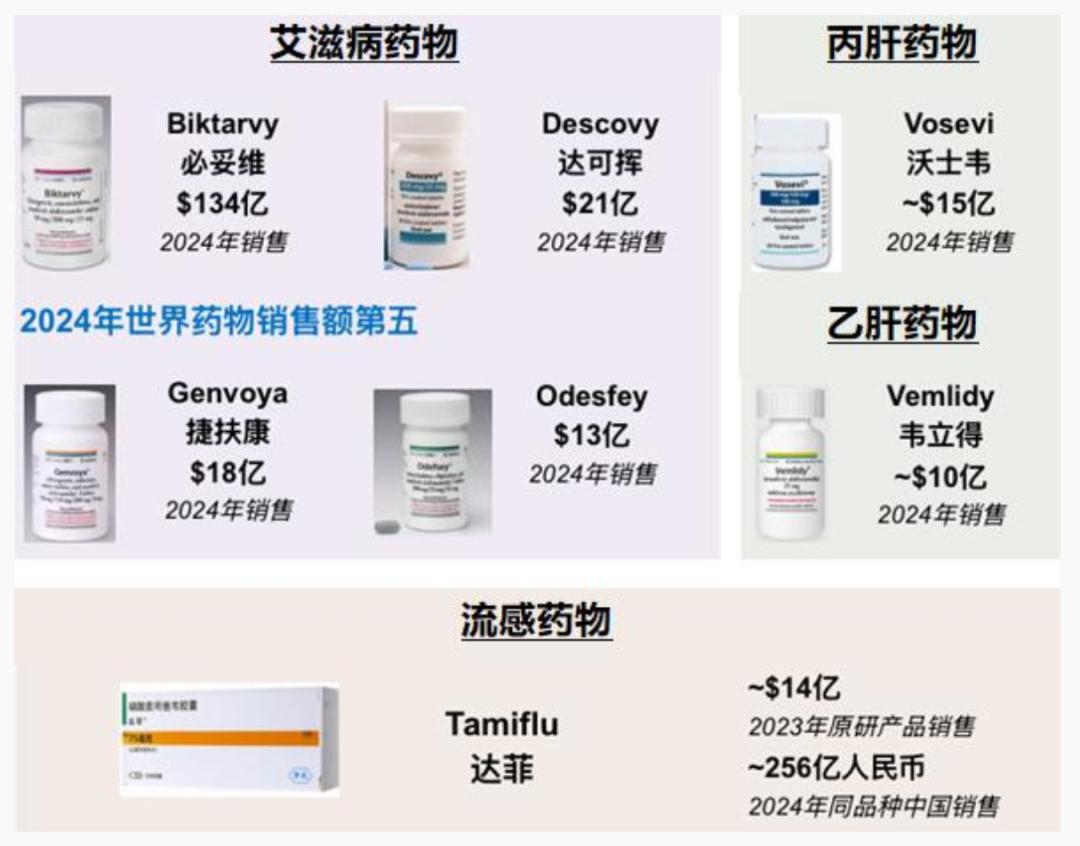
何公欣博士带领研发团队主导或直接参与研发的已上市产品——基于前药技术平台及抗病毒药物技术平台开发的重磅Best-in-Class新药
从吉利德到柯君医药
何公欣博士的职业经历与前药技术产业化的关键阶段高度重合。他的学术根基扎根于华东理工大学合成化学专业,后赴日本九州大学深耕有机合成与药物化学,又在美国加州大学完成博士后研究,系统构建了药物设计与化学合成的双重能力。这为他日后投身前药领域研发,奠定了坚实的基础。
博士后研究结束后,何公欣博士加入了处于高速成长期的吉利德。
在吉利德近30年的研发生涯中,他深度参与并推动了前药技术的发展,不仅主导多个国际“同类最佳”新药研发,更作为主要发明人及研发项目负责人,推动了目前全球广泛使用的抗乙肝病毒药物替诺福韦新一代前药——替诺福韦艾拉酚胺(TAF)的诞生。
此外,他还是多个抗病毒疗法的共同发明人,在心脑血管、核酸药物及多种抗病毒治疗领域积累了深厚经验。

何博士参与编写的前药技术相关专著
2008年,何公欣博士回国出任吉利德中国区首席代表及首任总经理,负责吉利德在国内搭建区域分部工作。在此期间,何公欣博士从一位药物研发者逐渐成为一位负责生产运营、供应链管理以及企业发展的管理者。
至2018年,担任吉利德中国区负责人已整整10年的他,对国内医药运行体系建立了深刻理解,也积累了广泛资源。也正是在这个时候,“参与到中国生物医药领域的发展中,促进国内医药健康行业发展”的想法再次在何公欣博士心里涌现。
最终,这位已成为全球前药领域权威专家的科学家选择离开吉利德,在上海创立柯君医药,聚焦前药技术的下一代突破。
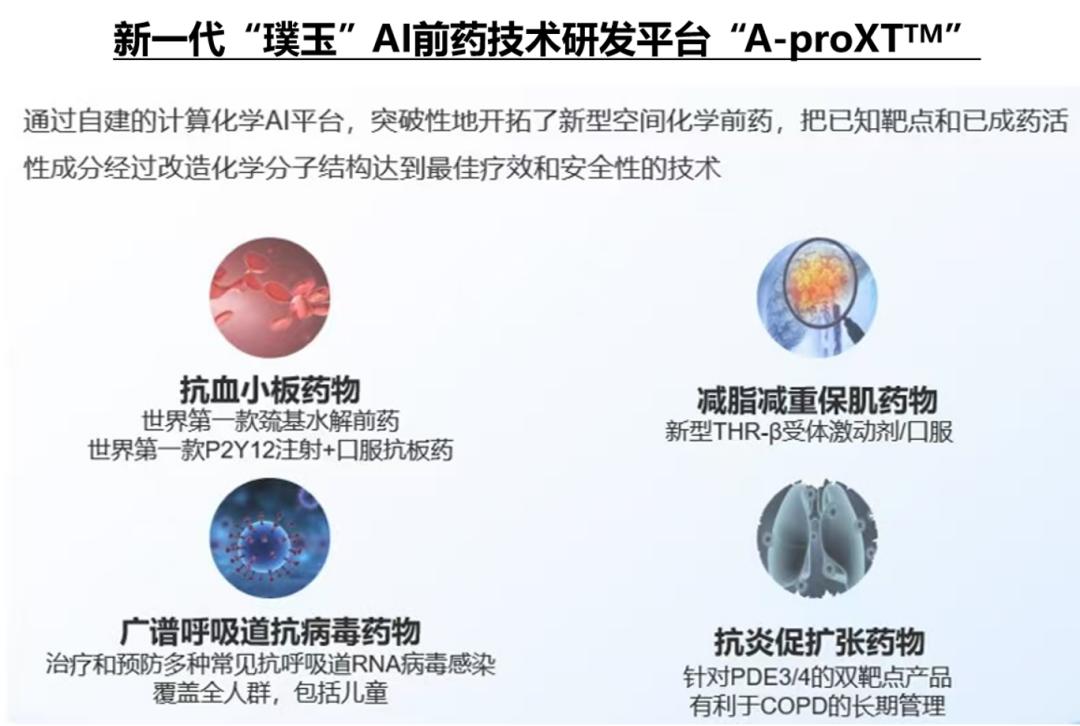
在柯君医药,何公欣博士充分发挥其在化学合成、研发项目管理、供应链管理和企业管理等方面的丰富经验。凭借他对前药技术的深刻理解,短短数年时间,柯君医药完成A-ProX(璞玉AI前药技术平台)的搭建,通过AI模型预测组织特异性活化位点、通过化学修饰实现空间优化设计实现特异性释放,双管齐下共同推动前药从“被动修饰”走向“主动诊疗”。
这一布局,让柯君医药在创新药研发赛道稳步前行,逐步在行业内崭露头角。
两款全球潜力新药
基于“璞玉”AI前药技术研发平台,柯君医药成功开发出多款具有全球自主知识产权且市场潜力巨大的创新药物。其中,CG-0255的临床数据展现出成为Best-in-Class(同类最佳)药物的潜力,CG-0416在临床前研究中也显示出显著的疗效优势和市场潜力,具备成为突破性疗法的潜质。
柯君医药自主研发的新一代抗血小板药物CG-0255,是一款创新型的P2Y12受体拮抗剂,采用创新性的水解前药设计,这一设计在药物化学层面实现了多个国际首创突破,使其成为全球第一款进入人体试验阶段的水解硫醇前药。
目前,心脑血管疾病已成为全球范围内的主要死亡原因之一,抗血小板治疗在该领域至关重要。传统抗血小板药物如氯吡格雷,存在诸多缺陷,其依赖氧化代谢途径在体内代谢形成活性成分,导致个体差异大、存在氯吡格雷抵抗问题、起效慢,且仅有口服剂型,限制了其在紧急状况下的临床应用。
CG-0255则有效克服了这些问题。它通过羧酸酯酶转化生成活性代谢产物H4,与氯吡格雷的活性代谢产物相同,却能高效、快速、一致地抑制血小板聚集。羧酸酯酶在人体内广泛存在和分布,这一创新型活化途径使CG-0255能够绕过肝酶代谢,从而避免了一系列临床应用问题,如现有药物的耐药性、生物转化率低、药物-药物相互作用等。
临床数据显示,CG-0255具有诸多显著优势。在起效时间方面,其药效达峰时间小于15分钟,通过静脉推注的给药方式能迅速干预动脉血栓形成,显著提升治疗效果,充分适配真实世界临床实践的需求。在安全性上,CG-0255表现出色,几乎不存在个体差异,且由于其优越的代谢路径设计,在起效过程中几乎不受药物相互作用的限制,这使得其在临床使用中具有极大的灵活性和便利性。
目前,CG-0255已在美国完成注射和口服两种剂型的二期临床试验,并已启动III期临床研究,同时也获得了中国国家药品审评中心(CDE)临床试验批件并完成临床桥接研究,实现中美同步推进临床开发,有望为心脑血管疾病患者提供更优质的治疗选择。
在代谢性肝病治疗领域,柯君医药的CG-0416同样备受关注。
代谢相关性脂肪性肝炎(MASH)长期以来困扰着全球医药行业,是一个亟待解决的医学难题。CG-0416是基于已验证的MASH治疗靶点THR-β全新设计的创新性前药,能够在肝脏内靶向代谢产生活性代谢物,全面降低肝脏内脂肪蓄积,改善炎症并降低纤维化水平。其临床前研究数据显示,CG-0416在针对代谢性肝病方面具有优于同靶点代表药物的体内外药效潜力。
同时,得益于柯君医药独特精巧的前药设计,CG-0416兼具更高的安全性潜力,有利于针对代谢性肝病的慢病干预和长期管理。更为重要的是,最新研究数据表明,CG-0416与GLP-1受体激动剂联用还具有极佳的强化协同效应,能够实现口服给药,使用方便,在快速减重降脂的同时,还能能够更好地维持肌肉水平。
2025年5月欧洲肝脏研究协会(EASL)年会上公布的临床前数据显示,其在代谢功能障碍相关脂肪肝炎(MASH)与减重联合治疗中展现三重价值:降低肝脏脂肪蓄积(降低58%)、快速降低体重(效果提升66%)、保持肌肉水平(流失率降低50%),为该领域提供了全新治疗方案。

A-ProX(璞玉-AI前药技术)平台的优势
前药技术4.0时代
前药技术的本质,是一场分子层面的“特洛伊木马”行动。它将无药理活性的小分子物,通过特定的生物转化机制在体内转化为活性成分并有效释放。这种设计理念的核心,在于通过合理的化学修饰,克服原型药物在吸收、分布、代谢、排泄或毒性方面的固有缺陷。
前药技术的演进已历经六十余年。1958年英国科学家Adrien Albert提出系统概念后,其发展大致可分为三个阶段:
初代前药技术处于简单酯化阶段。早期前药依赖酯化、酰胺化等基础反应掩蔽极性基团,此类设计虽简单易行,但缺乏靶向控制能力,活化依赖泛表达的酯酶,难以解决组织选择性难题。经典案例如阿司匹林,通过水杨酸的乙酰化修饰形成前药,能够在减少胃刺激同时提升药物稳定性。
第二代前药技术为引导结构型前药。引入引导结构连接药物与功能基团,显著提升设计灵活性,核心创新经典案例如核苷类抗病毒药物中广泛使用的ProTide技术,其设计采用芳基-氨基酸酯复合结构保护磷酸基团,前药进入细胞后,经细胞内羧酸酯酶和蛋白酶A水解氨基酸酯,产生的羧基负离子攻击磷原子触发分子内环化释放核苷单磷酸,进一步磷酸化形成活性成分核苷三磷酸。
这个技术的核心在于通过前药设计有序地控制了前药的转换和核苷磷酸化,最终产生活性成分核苷三磷酸,从而大幅提升抗病毒效果并降低潜在毒性。2013年上市的索磷布韦(Sofosbuvir)成为首个治愈丙肝HCV的口服药物,印证了该技术的临床价值。
第三代前药技术为微环境触发型前药。利用疾病微环境或特异性酶代谢路径进行针对性化学结构设计,从而实现靶向精准活化。如目前广泛使用的抗病毒药物替诺福韦的新一代前药丙酚替诺福韦,通过前药技术实现肝细胞/淋巴细胞靶向递送,给药后经肝细胞内羧酸酯酶1(CES1)选择性在肝细胞内活化,并经淋巴细胞内蛋白酶A选择性在淋巴细胞内活化,从而提高药效并降低全身暴露量,尤其是肾毒性较原药下降90%。
这一创新设计使丙酚替诺福韦成为新一代药效高安全性好的抗病毒药物,广泛适用于治疗乙肝和艾滋病。
近年来,随着人工智能(AI)和计算机技术的飞速发展,前药设计进入了智能化时代。AI技术能够通过挖掘分子结构、生物活性等数据,辅助预测药物活性与成药性,大幅提升研发效率。
在柯君医药,基于“AI+空间化学”的最新一代前药技术正引领着创新药研发的新潮流。
该技术从AI建模出发,根据目标靶点预测组织特异性活化位点,然后通过丰富数据库积累,挑选适当的基团针对性完成化学修饰,通过空间化学的优化设计实现特异性释放,根据临床开发需求提升药物性质,从而大大提高研发的成药性,能够高效地产生具有临床开发价值的候选化合物。
CG-0255与CG-0416在空间化学和精准医疗层面的持续突破,标志着前药技术正式迈入“智能化、精准化、个性化”的4.0时代。
从前药技术六十多年的演进轨迹看,这项技术已从单纯的药代动力学优化工具,成长为精准化药物设计的核心引擎。柯君医药所探索的“AI+空间化学”路径,在推动中国前药研发向全球前沿靠拢的同时,也凭借差异化的管线布局,为部分未被满足的临床需求提供了新的解决思路。随着技术持续突破,前药有望在更多疾病领域实现突破,最终完成从“分子修饰”到“患者获益”的完整价值闭环。

